在一个U形管里盛有CuCl2溶液,并插入两块锌片作电极,按如图连接。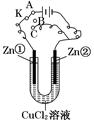
(1)如果把电键K接A,该装置应是电解装置,Zn①极是 极,电极反应式为 ,Zn②极是 极,电极反应式为 。
(2)上述反应进行5 min后,转换电键K到C,则这个装置是原电池装置,Zn①极是 极,电极反应式为 。
(3)上述装置进行2 min后,再转换电键K到B,则Zn①极发生的化学反应为 ,Zn②极发生的有关电化学的反应为 。
有A、B、C、D、E、F六种主族元素,已知:
(a) A原子有四个电子层,其K、L层电子数分别与N、M层电子数相等
(b) B、C原子核外电子层比A原子少一层,B的最高正价和负价的代数和等于零.C的气态氢化物化学式是H2C.
(c) D、E的阴离子都带一个单位的负电荷,D的阴离子电子层结构与氩原子相同.E元素没有对应的含氧酸.
(d)F与A属同一周期且是上述六种元素中原子半径最大元素。
则(1)它们的元素名称为:
A:_______ B:________ C:_______ D:_________ E:________F:____
(2)试比较A、C、D、F四种元素的离子半径的大小(用离子符号表示)
(3)B、C、D元素的气态氢化物的稳定性有强到弱的顺序为
(10分)下表为元素周期表的一部分,列出了10种元素在元素周期表中的位置。
| ① |
|||||||||||||||||
| ⑥ |
⑦ |
||||||||||||||||
| ② |
④ |
⑤ |
⑧ |
||||||||||||||
| ③ |
⑩ |
||||||||||||||||
| ⑨ |
试回答下列问题:
(1)10种元素中,原子半径最大的是(填序号)。⑥与⑧形成化合物的化学式为;
(2)②、③、④三种元素最高价氧化物的水化物的碱性由强到弱的顺序是(填化学式)。
(3)元素⑦的氢化物与⑧的单质反应的离子方程式为。
(4)元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为。
(5)元素⑩在地壳中的含量居第四位,是目前应用最广泛的一种金属,其单质与⑧的氢化物的水溶液反应的化学方程式为。
I.在元素周期表中,金属性最强的元素(不包括放射性元素)是(填元素符号,下同);最活泼的非金属元素是;最高价氧化物对应水化物的酸性最强的元素是;原子半径最小的元素是。
II.⑴处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的碱性比B弱,A处于B的边(左或右);B的原子半径比A;若B的最外层有x个电子,则A最外层有个电子(用含x的式子表示)。
⑵处于同主族的相邻两种非金属元素A和B,A的最高价氧化物的水化物的酸性比B弱,A处于B的边(上或下);B的原子半径比A;若B的原子序数为x且核外电子层数为3,且则A的原子序数为(用含x的式子表示)。
用化学用语回答下列问题
(1)用电子式表示: Na2O2;
(2)用电子式表示Na2S的形成过程:
(3)用原子符号表示中子数为18的硫离子:
(4)空气中含量最多的气体单质分子的结构式 .
(5)氯化铵、次氯酸钠中均含有的化学键是
(6)原子序数为15的原子结构示意图:、其最高价氧化物对应的水化物的化学式、其气态氢化物的分子空间构型为。
在1.0 L密闭容器中放入0.10 molA(g),在一定温度进行如下反应应:
A(g) B(g)+C(g) ΔH =+85.1kJ·mol-1
B(g)+C(g) ΔH =+85.1kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
| 总压强p/100kPa |
4.91 |
5.58 |
6.32 |
7.31 |
8.54 |
9.50 |
9.52 |
9.53 |
9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为。平衡时A的转化率为_,列式并计算反应的平衡常数K 。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总=mol,n(A)= mol。
②下表为反应物A浓度与反应时间的数据,计算a=。
| 反应时间t/h |
0 |
4 |
8 |
16 |
| c(A)/(mol·L-1) |
0.10 |
a |
0.026 |
0.0065 |
分析该反应中反应反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是,
由此规律推出反应在12h时反应物的浓度c(A)为mol·L-1。