在1.0 L密闭容器中放入0.10 molA(g),在一定温度进行如下反应应:
A(g) B(g)+C(g) ΔH =+85.1kJ·mol-1
B(g)+C(g) ΔH =+85.1kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
| 总压强p/100kPa |
4.91 |
5.58 |
6.32 |
7.31 |
8.54 |
9.50 |
9.52 |
9.53 |
9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为 。平衡时A的转化率为_ ,列式并计算反应的平衡常数K 。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总= mol,n(A)= mol。
②下表为反应物A浓度与反应时间的数据,计算a= 。
| 反应时间t/h |
0 |
4 |
8 |
16 |
| c(A)/(mol·L-1) |
0.10 |
a |
0.026 |
0.0065 |
分析该反应中反应反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是 ,
由此规律推出反应在12h时反应物的浓度c(A)为 mol·L-1。
实验室为测定一新配的稀盐酸的准确浓度。通常用纯净的Na2CO3(无水)配成溶液进行滴定。具体操作是:称取W克纯净无水Na2CO3装入锥形瓶中,加适量的蒸馏水溶解。在酸式滴定管中加入待测盐酸滴定至完全反应。
(1)碳酸钠溶液呈明显的碱性,主要原因是(用离子方程式表示)。
当用热水溶解时碱性更强是因为。
(2)由于CO2溶在溶液中会影响pH值,为准确滴定,终点宜选在pH值4—5之间,那么在石蕊、甲基橙、酚酞三种指示剂中应选用。终点颜色变化是。
(3)若达到滴定终点时,中和W克Na2CO3消耗盐酸V毫升,则盐酸的物质的量的浓度为 mol/L。
(4)若所称取的Na2CO3不纯,则测得盐酸的浓度就不准确。现设盐酸的准确浓度为C1 mol/L,用不纯的Na2CO3标定而测得盐酸浓度为C2 mol/L。在下述情况下,C1与C2的关系是(填“>”或“<”或“=”):
①当Na2CO3中含有NaHCO3时,则C1C2
②当Na2CO3中含有NaOH时,则C1C2
在一个温度恒定的密闭容器中,发生反应2SO2+O2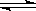 2SO3,请按要求回答下列问题.
2SO3,请按要求回答下列问题.
[恒定压强条件下]
(1)若开始时放入1 mol SO2和0.5 mol O2,达平衡后,生成0.9 mol SO3,这时SO2的转化率为________.
(2)若开始时放入4 mol SO2和2 mol O2,达平衡后,生成SO3的物质的量为________。
[恒定容积条件下]
(3)若开始时放入1 mol SO2和0.5 mol O2,达平衡后,生成a mol SO3,则a________0.9(填“>”、“<”或“=”).
(4)若令x、y和z分别代表初始加入SO2、O2和SO3的物质的量,要使达平衡时,反应混合物中三种气体的物质的量分别与(3)中平衡时完全相同,且反应正向进行,则必须满足的等式关系是______________________.(用x、y、z代数式表示),x的取值范围是。
已知某溶液中只存在OH一、H+、NH4+、Cl一四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl一)>c(NH4+)> c(H+)> c(OH-)
②c(Cl一) >c(NH4+)> c(OH-)> c(H+)
③c(NH4+)>c(Cl一)> c(OH-)> c(H+)
④ c(Cl一) >c(H+)> c(NH4+)> c(OH-)
填写下列空白:
(1)由若溶液中只溶解了一种溶质,则该溶质是__________,上述四种离子浓度的大小顺序符合___________(填序号)
(2)若溶解两种溶质,上述关系中③是正确的,则溶液中的溶质为____________________;
若溶解两种溶质,上述关系中④是正确的,则溶液中的溶质为____________________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)___________c(NH3·H2O)(填“大于”、“小于”或“等于”下同),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)____________ c(OH-)。
已知化学反应①:Fe(s)+CO2(g)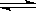 FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)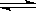 FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
| 温度 |
K1 |
K2 |
| 973 K |
1.47 |
2.38 |
| 1173 K |
2.15 |
1.67 |
请填空:
(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g)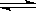 CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=.
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=.
(3)在相同温度下,根据反应①与②可推导出K1、K2与K3之间的关系式________,据此关系式及上表数据,也能推断出反应③是________(填“吸热”或“放热”)反应.
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有________(填写字母序号,下同).
A.增大压强 B.体积不变时充入稀有气体 C.升高温度
D.使用合适的催化剂 E.在体系中投入少量P2O5固体
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:①图甲中t2时刻发生改变的条件可能是________________.
②图乙中t2时刻发生改变的条件可能是.
A.升高温度 B.降低温度 C.加入催化剂 D.增大压强
E.减小压强 F.充入CO2 G.分离出部分CO
近年来,由CO2催化加氢合成甲醇的相关研究受到越来越多的关注。该方法既可解决CO2废气的利用问题,又可开发生产甲醇的新途径,具有良好的应用前景。已知4.4 g CO2气体与H2经催化加氢生成CH3OH气体和水蒸气时放出4.95 kJ的能量。
(1)该反应的热化学方程式为:__________________________________________.
(2)在270℃、8 MPa和适当催化剂的条件下,CO2的转化率达到22%,则4.48 m3(已折合为标准状况)的CO2在合成CH3OH气体过程中能放出热量________ kJ.
(3)又已知H2O(g)===H2O(l) ΔH=-44 kJ/mol,则CO2气体与H2气体反应生成CH3OH气体16g和液态水时放出热量为kJ.