高温下,某反应达平衡,平衡常数K=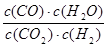 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为CO+H2O CO2+H2 CO2+H2 |
已知:25 ℃时,CaCO3的Ksp=2.8×10-9,CaCO3在水中的溶解平衡曲线如图所示。下列说法正确的是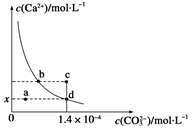
| A.x数值为1.4×10-5 |
| B.b点与d点对应的溶度积相等 |
| C.加入蒸馏水可使溶液由d点变到a点 |
| D.c点将有沉淀生成,平衡后溶液中c(Ca2+)、c(CO32-)一定相等 |
下列实验操作正确且能达到预期目的的是
| 实验目的 |
操作 |
|
| A |
比较水和乙醇中羟基氢的活泼性强弱 |
用金属钠分别与水和乙醇反应 |
| B |
欲证明CH2=CHCHO中含有碳碳双键 |
滴入酸性KMnO4溶液,看紫红色是否褪去 |
| C |
确定碳、氯两元素非金属性的强弱 |
测定同温同浓度的Na2CO3和NaClO水溶液的pH |
| D |
欲除去苯中混有的苯酚 |
向混合液中加入浓溴水,充分反应后,过滤 |
下列有关物质的性质和应用叙述正确并且有因果关系的是
| A.烧碱具有碱性,能用于治疗胃酸过多 |
| B.焦炭具有还原性,一定条件下能将二氧化硅还原为硅 |
| C.浓硝酸具有强氧化性,能和浓氨水反应产生白烟 |
| D.二氧化硫具有漂白性,与氯水混合使用漂白效果更好 |
含有下列各组离子的溶液中,通入过量SO2气体后仍能大量共存的是
| A.H+、Ca2+、Fe3+、NO3- | B.Ba2+、ClO-、Na+、OH- |
| C.Na+、NH4+、I-、HS- | D.Na+、Ca2+、K+、Cl- |
NA表示阿伏加德罗常数,下列叙述正确的是
| A.Na2O和Na2O2的混合物共1mol,阴离子数目为NA |
| B.过量的Fe与Cl2反应生成0.1mol产物时失去的电子数为0.2NA |
| C.标准状况下,11.2 LCHCl3中含有C-Cl键的数目为1.5NA |
| D.一定条件下,2 mol H2和0.5 mol N2充分反应后可得到NH3分子数为NA |