在浓HNO3中放入铜片:
(1)反应开始时的化学方程为 。
(2)若有铜剩余,则反应快要结束时的化学方程式为 。
(3)待反应停止时,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因和离子方程式是 。
(4)若将12.8g铜与一定质量的浓硝酸反应,铜耗完时,共产生气体5.6 L(标准状况),则消耗硝酸的物质的量是 ,所得气体的平均相对分子质量为 。
(5)若将(4)中所得物质配成100mL 溶液,下列操作可能使所配溶液浓度偏小的是_______ ___(填写序号)。
①未洗涤烧杯和玻璃棒②定容摇匀静置后,发现液面低于刻度线后继续加水至凹液面与刻度线相切③配溶液前容量瓶中有少量蒸馏水④定容时俯视容量瓶的刻度线
所得硝酸铜的物质的量浓度为 mol/L。
(4分)取14.3gNa2CO3•XH2O溶于水配成100mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸20.0mL,并收集到1.12LCO2(标准状况)。试计算:
(1)稀盐酸物质的量浓度为 mol/L;
(2)x值是。
(4分)拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能。下表是某些共价键的键能:
| 共价键 |
H-H |
O=O |
H-O |
| 键能/kJ ·mol-1 |
436 |
498 |
X |
根据下图中能量变化图,回答下列问题: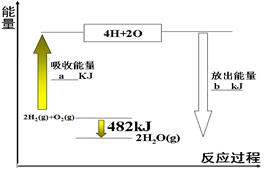
(1) 图中:a=___________。
(2) 表格中:X=。
(4分)(1)写出下列物质的化学式:①漂白粉的有效成分:;②钡餐:。
(2)写出用Na2SO3与浓H2SO4反应制备SO2的化学方程式:。
请回答以下问题:
(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元素对应原子的M层电子排布式为。
(2)如下图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是。简述你的判断依据
。
(3)CO2在高温高压下所形成的晶体其晶胞如下图3所示.该晶体的类型属于(选填“分子”“原子”“离子”或“金属”)晶体。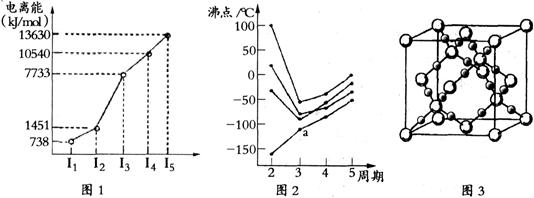
(4)BCl3原子的杂化方式为。第一电离能介于B、N之间的第二周期元素有
种。写出与BCl3结构相同的一种等电子体(写离子)。
(5)Cu元素形成的单质,其晶体的堆积模型为______,D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是________(填选项序号)。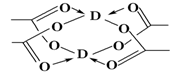
①极性键 ②非极性键 ③配位键 ④金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图中正确的是.铁原子的配位数是,假设铁原子的半径是r cm,该晶体的密度是p g/cm3,则铁的相对原子质量为(设阿伏加德罗常数的值为NA)。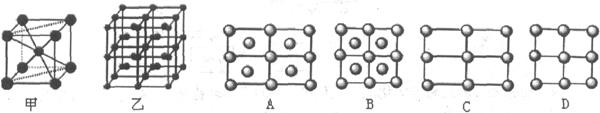
科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g)  2NH3(g)
2NH3(g) H="-92.4" kJ/mol,该反应的能量变化如图所示。
H="-92.4" kJ/mol,该反应的能量变化如图所示。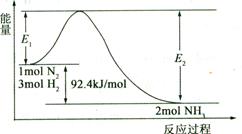
①在反应体系中加入催化剂,反应速率增大,E2的变化是(填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的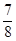 ,此时H2的转化率为(计算出结果);欲提高该容器中H2的转化率,下列措施可行的是(填选项字母)。
,此时H2的转化率为(计算出结果);欲提高该容器中H2的转化率,下列措施可行的是(填选项字母)。
| A.向容器中按原比例再充入原料气 | B.向容器中再充入一定量H2 |
| C.改变反应的催化剂 | D.液化生成物分离出氨 |
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(1)  4NH3(g)+3O2(g)
4NH3(g)+3O2(g) H="+1530" kJ/mol
H="+1530" kJ/mol
又知:H2O(1)=H2O(g)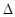 H="+44.0" kJ/mol
H="+44.0" kJ/mol
则2N2(g)+6H2O(g)  4NH3(g)+3O2(g)
4NH3(g)+3O2(g)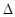 H =kJ/mol,该反应的化学平衡常数表达式为K=,控制其他条件不变,增大压强,K值(填“增大”、“减小”或“不变”)。
H =kJ/mol,该反应的化学平衡常数表达式为K=,控制其他条件不变,增大压强,K值(填“增大”、“减小”或“不变”)。