古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:
NaClO+ NH3·H2O  N2H4 + NaCl+ H2O
N2H4 + NaCl+ H2O
(1)请配平上述化学方程式。并用单线桥法标出电子转移的方向和数目。
(2)NH3·H2O在上述反应中显示出来的性质是 。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(3)该反应的氧化产物是 ,NaClO发生 反应。
(4)若生成 0.2 mol N2H4,则转移的电子为 mol。
2 g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075 mol/L KMnO4溶液处理,反应如下:8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的 KMnO4恰好与350 mL 0.1 mol/L (NH4)2Fe(SO4)2溶液完全反应,反应的离子方程式:MnO4-+5Fe2++8H+=Mn2++5 Fe3+ +4H2O
(1) KMnO4溶液与混合物反应,消耗KMnO4的物质的量为mol。
(2)欲配制500mL 0.1mol/L NH4+溶液,需称取 (NH4)2Fe(SO4)2·6H2O (M=392g/mol)的质量为 g。
(3)混合物中 Cu2S的质量分数为 。
环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以做内燃机的抗冻剂,J分子中无饱和碳原子。
已知:R1-CH=CH-R2 R1-CHO+R2-CHO
R1-CHO+R2-CHO
(1)F的名称是___________,C中含有的官能团的名称是______________。
(2)③的反应条件是_________________________。
(3)写出下列反应类型:⑥_________________,⑨______________。
(4)写出②反应化学方程式: ____________________________。
(5)写出⑩反应化学方程式:。
(6)试写出C与新制银氨溶液反应的化学方程式:_________________________
(7)D的一种同分异构体,可发生加成聚合反应,且能和NaHCO3反应,有三种氢原子,核磁共振氢谱面积比为1:2:3,试写出结构简式:________
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.
CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=mol/(L·min)
(2)该反应的平衡常数为。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是。
A.升高温度B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离D.再充入lmol CO2和3mol H2
(4)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H= —1275.6kJ/mol
②H2O(g)=H2O(1)△H= —44.0kJ/mol
则甲醇的燃烧热化学方程式为:;
(5)如果燃烧甲醇会造成大量化学能损失,如果以甲醇和空气为原料,以氢氧化钠为电解质溶液设计成原电池将有很多优点,请书写出该电池的负极反应:___________________
(6)常温下,某水溶液M中存在的离子有:Na+、A—、H+、OH—。若该溶液M由 pH=3的HA溶液 mL与pH=11的NaOH溶液
mL与pH=11的NaOH溶液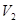 mL混合反应而得,则下列说法中正确的是 __。
mL混合反应而得,则下列说法中正确的是 __。
A.若溶液M呈中性,则溶液M中c(H+)+c(OH—)=2×10—7mol·L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
化合物BrFx与水按物质的量之比为3∶5发生反应,其产物为溴酸、氢氟酸、单质溴和氧气。(1)BrFx中,x=。
(2)该反应的化学方程式是。
(3)此反应中的氧化剂是_________和还原剂是_________。
某固体混合物可能含Al、(NH4)2SO4、MgCl2、A1Cl3、FeCl2、NaCl中的一种或几种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标况下体积):





 请回答
请回答 (1)混合物中是否存在FeCl2_________(填“是”或“否”);
(1)混合物中是否存在FeCl2_________(填“是”或“否”); (2)混合物中是否存在(NH4)2SO4_____(填“是”或“否”),你的判断依据是_______。
(2)混合物中是否存在(NH4)2SO4_____(填“是”或“否”),你的判断依据是_______。 (3)写出反应⑤的离子反应方程式;___________________________________。
(3)写出反应⑤的离子反应方程式;___________________________________。 (4)请根据图中数据分析,原固体混合物的成分为
(4)请根据图中数据分析,原固体混合物的成分为 _____________________(写化学式)。
_____________________(写化学式)。