相对分子质量为174的有机物M中只含有C、H、O三种元素,其分子结构如图所示。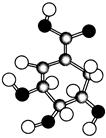
请回答下列问题:
(1)M的结构简式是________________________。
(2)下列关于M的说法,正确的是________。
A.遇FeCl3溶液呈紫色
B.遇紫色石蕊溶液变红色
C.遇溴水发生取代反应
D.能缩聚为高分子化合物
(3)M在一定条件下发生消去反应,生成 ,该反应的化学方程式是_________。
,该反应的化学方程式是_________。
(4)M与有机物A在一定条件下可生成一种相对分子质量为202的酯类物质。A可能的结构简式是______________________。
(5)研究发现,有一种物质B的分子组成和M完全一样,但分子中无环状结构;B在一定条件下水解能够产生甲醇;B的核磁共振氢谱如图(两个峰面积比为2∶3)。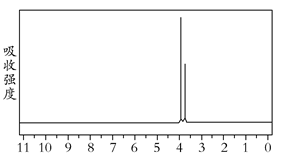
物质B的结构简式是____________。
(10分)在常温常压下,都用惰性材料作电极.分别电解(同浓度、同体积、通过相同电量)下列溶液:
| A.CuSO4 | B.AgNO3 | C.KOH | D.H2SO4 E.NaCl F.Na2SO4 |
通电一段时间切断电源,请填写下列空白。
(1)在A中一个电极上质量增加了0.128 g,在B中一个电极上质量增加,增加的物质是.
(2)在一极产生O2,同时另一极产生H2(填写序号,下同).
(3)电解后,溶液中的C(OH-)增大
(4) 电解后,溶液的pH减小.
(5)电解后,溶液的浓度增大而[H+]不变.
电解原理在化学工业上有着广泛的应用。图中电解池a为电解液,X和Y是两块电极板。则:
(1)若X和Y均为惰性电极,a为饱和的NaCI溶液,则电解时检验Y电极反应产物的方法是 。
(2)若X、Y分别为石墨和铁,A乃为饱和的NaCl溶液,则电解过程中生成的白色固体物质露置在空气中,可观察到的现象为 。
(3)若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 mol Cu(OH)2,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
为节省药品和时间.甲、乙、丙三位同学用铜片、锌片、稀硫酸、直流电源、导线、烧杯、试管等中学化学常见的药品和仪器(用品),以巧妙的构思,“接力”的方式,设计了比较铜与锌金属活动性相对强弱的系列实验。试填写下列空白:
(1)甲同学将铜片和锌片插入盛有稀硫酸的烧杯中(铜与锌不接触),观察到的现象是 。
(2)乙同学接着甲同学的实验,用导线将铜片和锌片连接起来组成原电池,此时在正极上观察到的现象是 ,负极的电极反应式为 。
(3)丙同学接着乙同学的实验,去掉连接铜片和锌片的导线,将铜片和锌片分别与同一直流电源的正极和负极连接,再向烧杯中加入一定量的CuSO4溶液进行电解。此时阴极的电极反应式为 ,电解过程中溶液的pH (填“增大”、“减小”或“不变”)。
(4)甲、乙、丙3位同学能达到比较铜和锌的金属活动性相对强弱的目的的是 。
| A.只有甲同学 | B.甲和乙同学 |
| C.乙和丙同学 | D.甲、乙和丙同学 |
在元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高。
(1)B元素在周期表中的位置;D元素基态原子电子排布式为_______________。
(2)E的气态氢化物在同族元素中沸点最高的原因是:。
(3)A、C两元素第一电离能> 。(填元素符号)
(4)B元素能形成多种配合物。元素之间形成配合物的条件是:一方是能够提供孤对电子的原子,另一方是的原子。
(5)A元素可与氢元素形成离子化合物,电子式为_______________;这种离子化合物可与水反应,化学方程式为________________________________。
(7分)黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg·kgˉ1。黄血盐易溶于水,在水溶液中会电离出K+和[Fe(CN)6]4ˉ,其中CNˉ的电子式为 。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O
。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
(1)上述反应是否为氧化还原反应?______ (填“是”或“不是”)。
(2)食盐经长时间火炒,“亚铁氰化钾”名称前的“亚铁”就去掉了,变成了剧毒物质氰化钾,这是因为黄血盐在超过4000C时会分解,试配平该反应的化学方程式: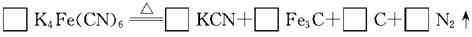
(3) 黄血盐可与高锰酸钾溶液反应,其化学方程式为
K4Fe(CN)6+ KMnO4+ H2SO4→KHSO4+ Fe2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平)
①该反应的氧化产物有______(填化学式)。
②若有1mol K4Fe(CN)6被高锰酸钾氧化,则消耗高锰酸钾的物质的量为______mol。