已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B 、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两个元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D四种元素电负性由大到小排列顺序为
(2)C形成的晶体中,其微粒堆积方式为 ;
(3)D单质的熔点很高,可用作计算机的核心部件,但会被氢氧化钠溶液腐蚀,其腐蚀的离子方程式为: ;D的氧化物在通讯方面有重要用途,90克D的氧化物中含共价键的数目为 。
(4)E核外电子排布式是 ,E的某种化合物的结构如图所示,则此化合物中各种粒子间的相互作用力有
(1)家用液化石油气的主要成分之一是丁烷(C4H10),当10 kg丁烷完全燃烧并生成二氧化碳气体和液态水时,放出的热量为5×105 kJ。试写出丁烷燃烧的热化学方程式:
。
已知1mol液态水汽化时需要吸收44 kJ热量,则1mol丁烷完全燃烧生成二氧化碳气体和气态水时,放出的热量为kJ。
(2)有同学制作一氢氧燃烧电池,通入H2的一极为极。若以稀硫酸为电解质溶液时,其正极反应式为。
如图是以石墨为电极电解CuCl2溶液的装置示意图。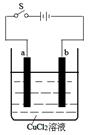
(1)电解过程中,a电极为极,该电极上发生的电极反应式为:。
(2)电解一段时间后,b电极上可观察到的现象是:。
(3)电解过程中能量转化的主要形式是。
现有以下物质:
①NaCl晶体; ②SO2; ③纯醋酸; ④铜;
⑤BaSO4固体; ⑥酒精; ⑦熔化的KNO3;
请回答下列问题(填序号):
(1)以上物质能导电的是;
(2)以上物质属于电解质的是;
(3)以上物质属于非电解质的是;
(4)以上物质中属于弱电解质的是。
氢气是一种清洁能源。制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题。(1)用甲烷制取氢气的两步反应的能量变化如下图所示: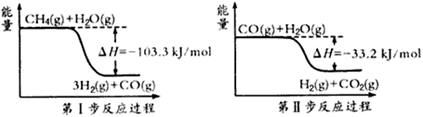
①甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是________________。
②第Ⅱ步反应为可逆反应。800℃时,若CO的起始浓度为2.0 mol·L-1,水蒸气的起始浓度为3.0 mol·L-1,达到化学平衡状态后,测得CO2的浓度为1.2 mol·L-1,则CO的平衡转化率为__________。
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B元素的化合价不变,该反应的化学方程式为,反应消耗1mol NaBH4时转移的电子数目为。
(3)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢。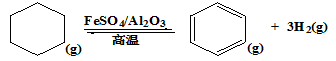
在某温度下,向恒容容器中加入环已烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=(用含a、b的关系式表达)。
(4)一定条件下,如下图所示装置可实现有机物的电化学储氢(除目标产物外,近似认为无其它有机物生成)。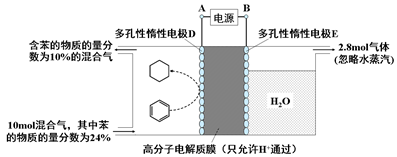
①实现有机物储氢的电极是;
| A.正极 | B.负极 | C.阴极 | D.阳极 |
其电极反应方程为:。
②该储氢装置的电流效率η明显小于100%,其主要原因是相关电极除目标产物外,还有一种单质气体生成,这种气体是。由表中数据可知,此装置的电流效率η=。[η=(生成目标产物消耗的电子数/转移的电子总数)×100%,计算结果保留小数点后1位]。
反应aA(g)+bB(g) cC(g) ΔH<0。在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示。
cC(g) ΔH<0。在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示。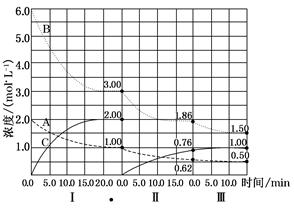
回答问题:
(1)反应的化学方程式中a∶b∶c为________;
(2)各阶段内,A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为;
(3)各阶段内,B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是_______,其值是________;
(4)由第一次平衡到第二次平衡,平衡移动的方向是,采取的措施是;
(5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2________T3(填“>”、“<”、“=”)。