反应aA(g)+bB(g) cC(g) ΔH<0。在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示。
cC(g) ΔH<0。在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示。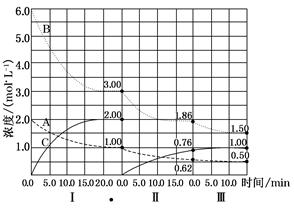
回答问题:
(1)反应的化学方程式中a∶b∶c为________;
(2)各阶段内,A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为 ;
(3)各阶段内,B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是_______,其值是________;
(4)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2________T3(填“>”、“<”、“=”)。
I、下列物质中属于强电解质的是;属于弱电解质的是;属于非电解质的是。(填序号)
①氨气 ②氨水 ③盐酸 ④醋酸 ⑤硫酸钡 ⑥银 ⑦氯化钠 ⑧二氧化碳 ⑨醋酸铵 ⑩氢气
II、某反应体系中的物质有:Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O。已知K2S2O8的氧化性比K2Cr2O7强。
(1)请将以上反应物与生成物编写成一个氧化还原反应方程式(不要求配平)
(2)反应中,被还原的物质是Cr2(SO4)3是
(3)在酸性条件下K2Cr2O7与草酸(H2C2O4)反应的产物是:Cr2(SO4)3、CO2、K2SO4和H2O,则还原剂与氧化剂物质的量之比为。
将 3a L NO2 气体依次通过盛有下列物质的容器:饱和NaHCO3 溶液、浓硫酸、固体Na2 O2 ,发生反应的化学方程式是(1)________,(2)________,(3)________。最后用排水法收集残余气体,收集到的气体是________,体积是________L。
常温下A和B两种气体组成的混合气体(A的相对分子质量大于B的相对分子质量),经分析混合气体中只含有氮和氢两种元素,而且不论A和B以何种比例混合,氮和氢的质量比总大于14/3。由此可确定A为________,B为________,其理由是______________________________________。
若上述混合气体的氮和氢的质量比为7∶1,则在混合气体中A和B的物质的量之比为________,A在混合气体中的体积分数为________。
根据下列变化进行推断: 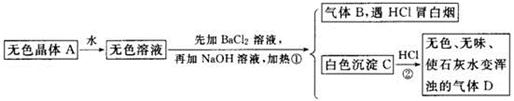
且已知对A加强热产生的气态物质的平均相对分子质量为26.3。
(1)推断A、B、C、D的化学式:A________,B________,C________,D________。
(2)写出①②变化的离子方程式:
①________________________________________________________________;
②________________________________________________________________。
通常情况下,下列物质只能作氧化剂的是________(填选项编号,下同);既可作氧化剂,又可作还原剂的是________。
①浓H2 SO4 ②稀H2 SO4 ③H2S ④SO2 ⑤S ⑥HCl ⑦浓HNO3 ⑧稀HNO3