下列操作中,能使电离平衡H2O H++OH-,向右移动且溶液呈酸性的是( )
H++OH-,向右移动且溶液呈酸性的是( )
| A.向水中加入NaHSO4溶液 | B.向水中加入Al2(SO4)3溶液 |
| C.向水中加入NaOH溶液 | D.将水加热到100℃,使pH=6 |
中药狼把草的成分之一M具有消炎杀菌的作用,M的结构如图所示: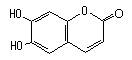 下列叙述正确的是
下列叙述正确的是
| A.M的相对分子质量是180 |
| B.1molM最多能与2molBr2发生反应 |
| C.M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
| D.1molM与足量NaHCO3反应能产生2molCO2 |
设NA为阿伏加德罗常数的数值,下列说法中正确的是
| A.1molFeCl3完全水解转化为Fe(OH)3胶体后能生成NA个胶体粒子 |
| B.常温常压下,a molO2与2 a mol NO混合,降温得到混合气体中氧原子数 小于4aNA |
| C.4.6 g C2H6O加入足量的金属钠,充分作用,生成氢气分子数一定为0.05NA |
| D.足量Zn与一定量的浓硫酸反应,产生22.4L(标况)气体时,转移的电子数 |
为2NA
下列叙述中正确的是
| A.含金属元素的离子都是阳离子 |
| B.将体积相同pH均为1的盐酸和醋酸加水稀释至pH为3,盐酸的体积变化大, 证明醋酸是弱酸 |
| C.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合液滴加1~2滴0.01mol·L-1 AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小 |
| D.金属阳离子被还原不一定得到金属单质 |
下列排列顺序正确的是
①固体热稳定性:Na2CO3>CaCO3>NaHCO3
②微粒半径:F->Na+>Mg2+>S2-
③燃烧热: S(气体)>S(液体)>S(固体)
④物质的熔点:植物油>动物油
| A.①③④ | B.①③ | C.①②③④ | D.②③④ |
下列说法正确的是
| A.用CCl4作萃取剂直接从海带中提取I2 |
| B.用向下排空气法收集NH3,并用湿润的蓝色石蕊试纸验满 |
| C.除去苯中溶有的少量苯酚:加入适量浓溴水后过滤 |
| D.制乙炔时滴加饱和食盐水是为了减缓电石与水的反应速率 |