室温时,在体枳相同日的容器内混合下列气体。混合后压强最小的是
| A.100mL H2和50mL O2 | B.100mL HCl和100mL NH3 |
| C.100mL NO和100mL O2 | D.100mL N2和200mL O2 |
常温下,把2.7g铝投入到一定量氢氧化钠溶液中,充分反应后,下列表示正确的是(NA为阿佛加德罗常数)
| 电子转移 |
反应的Al |
溶液中的AlO2- |
生成的H2 |
|
| A |
0.2NA |
0.1NA |
||
| B |
0.3NA |
0.3NA |
||
| C |
2.7g |
3.36L |
||
| D |
0.1NA |
2.7g |
漂粉精久置于空气中会变质,在变质过程中不会涉及的性质是
| A.HClO的漂白性 | B.HClO的不稳定性 |
| C.HClO的弱酸性 | D.H2CO3的酸性 |
居里夫人为了纪念自己的祖国,把她发现的元素命名为钋、镭,其中钋(84Po)元素的一种同位素的中子数是质子数的1.49倍。该原子的质量数为
| A.84 | B.125 | C.209.16 | D.209 |
有一种测定阿伏加德罗常数的方法需测定一定量NaCl晶体的体积,具体步骤为:准确称出一定量NaCl晶体置于定容仪器a中,用滴定管向仪器a中滴加某液体b 至a仪器的刻度线,即可测出NaCl晶体的体积。上述操作中的a、b分别指
| A.量筒、水 | B.容量瓶、四氯化碳 |
| C.量筒、苯 | D.容量瓶、水 |
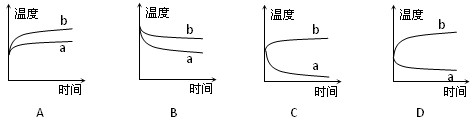
将硝酸铵晶体溶于水中,温度与时间变化曲线(其中a代表扩散过程中温度变化情况,b代表水合过程中温度变化情况)中符合实际的是