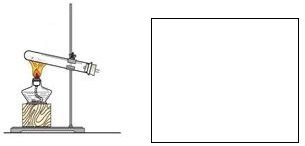
瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色有刺激性气味的气体──氯气。某实验小组的同学运用这一原理设计如图所示的实验装置制取干燥的氯气,并通过实验研究氯气的性质。
(1)仪器a的名称是 ,B中盛放的试剂是 ,D中盛放的试剂是 。
(2)向集满氯气的矿泉水瓶C中加入少量水,振荡后瓶子变瘪,溶液变成浅黄色,由此可得出的结论是: 。
(3)取少量(2)中所得溶液滴入到紫色石蕊溶液中,溶液先变为红色后又褪色。甲同学认为氯气与水发生了化学反应,生成物中有盐酸,验证有Cl-所需要的试剂是 。
乙同学认为氯气与水发生化学反应还有一种产物Q、盐酸、Cl2和Q三种物质均可使石蕊溶液褪色,他选用下列实验用品进行实验探究,请将实验报告填写完整。
实验用品:①石蕊溶液②蓝石蕊试纸③盛有盐酸的试管④盛有氯水的试管⑤充有干燥氯气的试管
| |
用品(填序号) |
现象 |
结论 |
| 实验1 |
①③ |
溶液呈红色 |
|
| 实验2 |
|
|
Cl2没有漂白性 |
| 实验3 |
|
|
Q具有漂白性 |
(15分)为验证溴乙烷在不同溶剂中与NaOH 反应生成不同的反应产物,进行了如下实验:
【实验1】
(1)右图所示装置的实验目的是;
观察到的II试管的现象是 ;
;
盛水试管(装置I)的作用是。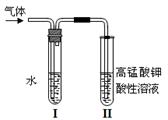
(2)用另一实验方案也可达到如上实验的目的,你认为另一实验方案依据的反应原理是(用化学方程式表示)
;
此时是否有必要将气体 先通入水中?填“是”或”否”
先通入水中?填“是”或”否” 。
。
【实验2】
(3)鉴定溴乙烷中存在溴元素:用试管取少量溴乙烷与NaOH 水溶液反应后的混合溶液,而后如何操作?请你设计合理的实验方案
 。
。
(4)下图是用核磁共振仪测得溴乙烷在氢氧化钠水溶液中反应生成某产物A的核磁共振氢谱图,据此推导未知物A的结构简式、写出溴乙烷在氢氧化钠水溶液中反应的化学方程式。
未知物A的核磁共振氢谱
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室用乙酸与乙醇反应制备乙酸乙酯。为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下四个实验 ,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验 编号 |
试管Ⅰ中的试剂 |
试管Ⅱ中试剂 |
测得有机层的厚度/cm |
| A |
2mL乙醇、2mL乙酸、1mL 18mol·L-1浓硫酸 |
5.0 |
|
| B |
3mL乙醇、2mL乙酸 |
0.1 |
|
| C |
3mL乙醇、2mL乙酸、6mL 3mol·L-1硫酸 |
1.2 |
|
| D |
3mL乙醇、2mL乙酸、盐酸 |
1.2 |
(1)试管Ⅱ中试剂的名称为,其作用是
,使用干燥管的目的是。
(2)分析比较实验(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是。
(3)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是mL和mol·L-1。
1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3进而生产出纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:NH3+CO2+H2O NH4HCO3;
NH4HCO3+NaCl NaHCO3↓+NH4Cl ; 2NaHCO3  Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因 (选填字母)。
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按设计的方案进行实验。将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。请回答:
①写出甲中发生反应的离子方程式 。
②乙装置中的试剂是 。
③实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。
(3)请你再写出一种实验室制取少量碳酸氢钠的方法(用简要的文字和相关的化学反应方程式来描述):
Ⅰ下面是几种实验中常用的仪器: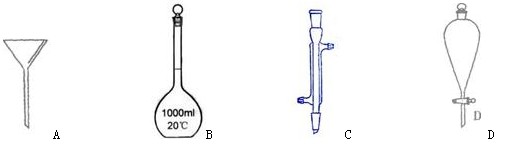
写出序号所代表的仪器的名称:
A___________;B___________;C___________;D___________
Ⅱ实验室要配制100 mL 2 mol/L NaOH溶液,请回答下列问题:
(1)配制过程中不需要使用的化学仪器有__________________(填选项的字母)。
| A.烧杯 | B.100 mL容量瓶 | C.漏斗 | D.胶头滴管 E.玻璃棒 |
(2)用托盘天平称取氢氧化钠,其质量为_______________g。
(3)下列主要操作步骤的正确顺序是___________(填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1-2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到100 mL 容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会使配制出的NaOH溶液浓度________(填 “偏高”或 “偏低”或 “不变” )。
写出实验室制氨气的化学方程式:_____________________________________________。
在下图方框内画出氨气的收集装置(夹持装置可略去)