通过你的观察和推理,判断下列实验室中对于少量Na的保存方法正确的是 ( )
| A.保存在水中 | B.密封,保存在广口瓶中 |
| C.用铝箔包裹,密封在广口瓶中 | D.密封,保存在煤油中 |
阿伏加德罗常数用NA表示,下列叙述正确的是
①常温常压下,2.24l D2气体分子含有的中子数为小于0.2NA
②含有0.32g氧元素的二氧化硅中含有的硅氧键数目为0.02NA
③0.44g C3H8中含有的极性共价键总数目为0.1NA
④7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.2NA
⑤46g 二氧化氮与四氧化二氮的泡合气体的平均相对分子质量为46<M<92
⑥11.2LC12通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA
⑦1mol冰醋酸和1mol乙醇在加热和浓硫酸条件下充分反应生成的水分子数为NA
| A.①④⑤ | B.⑤⑥ | C.②④⑤⑥⑦ | D.①③④⑤⑥ |
下列热化学方程式或离子方程式中,正确的是
A.在CH4、02和KOH溶液组成的燃料电池中,负极反应式为:
B.在5000C、30Mpa条件下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: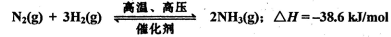
C.乙烯的燃烧热为 ,则乙烯燃烧的热化学方程式可表示为:
,则乙烯燃烧的热化学方程式可表示为: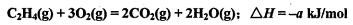
D.向苯酚钠(C6H5ONa)溶液中通入少量二氧化碳: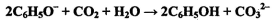
某澄清透明溶液,当溶液呈强酸性时,有气体放出,当溶液呈强碱性时,有白色沉淀生成。则该溶液中可能大量共存的离子组是
生产、生活中的-些问题常常涉及到化学知识,下列叙述不正确的是
| A.稻草、秸秆焚烧后的灰烬可以为庄稼提供肥料,所以应提倡稻草、秸秆的焚烧 |
| B.用稀双氧水清洗伤口可以杀菌消毒 |
| C.日本大地震后,防疫人员在震区周围撒石灰进行环境消毒,防止灾后出现疫情 |
| D.尽量购买本地的、当季的食物,符合节能、低碳生活理念 |
下列说法你认为不合理的是
| A.使用一次性筷子,既方便又卫生,且耗木才不多、应提倡大量使用。 |
| B.塑料像把双刀剑,它既可极大地方便人们的生活,又给环境带来污染。 |
| C.甲烷是优良的气体燃料,但矿井里由于它的存在,在通风不良时,易发生爆炸 |
| D.大气中CO2的浓度不断上升,使全球变暖,但同时也有利于植物光合作用。 |