(8分)有A、B两种常见化合物,其焰色反应均呈黄色,C是一种单质气体,相互转化关系如图所示(其他物质均已略去)。回答下列问题: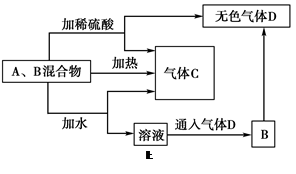
(1)写出A的电子式____________。
(2)①E溶液加少量稀硫酸的化学方程式_______________________________。
②B加稀硫酸产生D的离子方程式_______________________________。
(3)请用化学方程式表示A在潜水艇中的一种重要用途__________________________。
(每空2分,共10分)某溶液中仅含有下表中的一些离子(不考虑水的电离和离子的水解)
| 阳离子 |
Na+ Mg2+ Fe2+ Al3+Fe3+ |
| 阴离子 |
OH-Cl-CO32-NO3- SO42- |
为鉴定这些离子,取少量溶液加入稀HCl,有无色气体生成。该气体遇空气变为红棕色,且溶液中阴离子的种类不变;
(1)通过分析该实验,能确定溶液中一定存在的阳离子是 。一定存在的阴离子是 。
(2)写出实验中发生的离子方程式。
(3)通过对实验的分析,尚不能确定溶液中是否存在的阴离子是,如何进一步鉴别该离子是否存在。
(每空2分,共12分)仔细阅读下列三段文字
①由稀有气体元素Xe(氙)与氧元素形成的一种共价化合物XeO3极不稳定,易转化为单质而呈强氧化性。将适量的XeO3投入含Mn2+的水溶液中,溶液逐渐变为紫红色且pH不断减小。
②将0.08mol KMnO4固体(质量为12.64g)加热一段时间后,收集到a molO2;
向反应后残留的固体中加入足量的浓盐酸,又收集到b molCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
③氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式: Cl2+2e- =2Cl-
回答问题:
(1)试写出①有关的离子方程式:________________。
(2)请配平②的化学方程式:
KMnO4+HCl -KCl+MnCl2+Cl2↑+H2O
通过对第②段文字中提供的数据进行推导和计算可得出:
a +b的最大值为,a +b最小值为。
(3)下列四种物质中能使③中的还原过程发生的物质是。
| A.Na2CO3 | B.KMnO4 | C.XeO3 | D.Na2SO3 |
将该反应的氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥表示电子转移的方向和数目:
(每空2分,共14分)下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:
① G是一种红棕色粉末、C既能与盐酸又能与NaOH溶液反应
② I是一种常见的温室气体,它和 可以发生反应:2E+I
可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.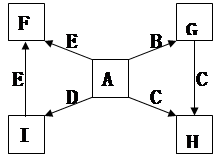
回答问题:
(1)写出G→H的化学方程式为________________________;
此反应在工业上常用于焊接钢轨,实验室在演示该实验时,在装置中加入G、C混合物后,引发此反应的操作是;
(2)化合物Ⅰ的电子式为______________________,
(3)用适量的盐酸溶解G后,所得溶液叫蚀铜剂,常用来洗涤印刷电路板上的铜,写出该反应的离子方程式为________________;
(4)E在I中燃烧观察到的现象是_______________________。
(5)在氩气的保护下,将一定计量的C、E加热熔炼可获得一种潜在的贮氢材料E17C12,该材料吸氢的反应方程式为E17C12+17H2 = 17EH2+12C
①熔炼制备贮氢材料E17C12时通入氩气的目的是
②1mol E17C12完全吸氢后,将得到的产物与足量的盐酸完全反应。释放出H2的物质的量为
关于铝的冶炼,有以下一些问题,请你通过努力,争取完成。
(1)工业制备铝一般是通过铝土矿制得的纯净的Al2O3,然后电解Al2O3/Na3AlF6得到铝。也可用电解NaCl—KCl—AlCl3共熔体方法制铝,且比电解Al2O3/Na3AlF6制铝节省电能约30%,但现在仍用前一种方法制铝,其主要原因是________(填字母序号)。
A.AlCl3是共价化合物,其熔融体不导电
B.电解AlCl3生成的Cl2会污染大气
C.自然界不存在富含AlCl3的矿石
D.生产无水AlCl3较困难,成本又较高
(2)把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为________(填字母序号)
A.1∶2∶3 B.3∶2∶1 C.6∶3∶1 D.6∶3∶2
(3)有些同学查到了有关几种物质的熔、沸点的资料,并对第(2)小题进行评价。
| 物质 |
K2O |
MgO |
Al2O3 |
KCl |
MgCl2 |
AlCl3 |
| 熔点(℃) |
881 |
2 852 |
2 015 |
711 |
714 |
190(259 kPa) |
| 沸点(℃) |
—— |
3 600 |
2 980 |
1 437 |
1 412 |
181 |
①有的认为第(2)小题的题干与选项有矛盾,若选项正确,则可推知氯化钾、氯化镁、氯化铝三种物质中有一种物质是不符合题意的,这种物质是________。
②有的认为第(2)小题的题干正确,只要补一个正确的选项即可,这个选项是________(填序号)。
Ⅰ.0∶0∶0 Ⅱ.6∶3∶0 Ⅲ.1∶3∶6
③也有的认为只要把第(2)小题中三种物质中的某一种改为表格中的另一种物质也符合题意。请写出电解这种物质的化学方程式:__________________________________________。
(4)讨论含有活泼金属元素的化合物一定是离子化合物吗?并设计简单实验证明你的结论。
在灰黑色粉末A和白色粉末B组成的混合物中加水,先看到蓝色溶液,过一段时间溶液变为浅绿色,并同时析出红色沉淀C。将沉淀C过滤出来,加入浓硫酸共热,有气体放出,将溶液浓缩,结果得到晶体D,把晶体D继续加热,又得到白色粉末B。试推断A、B、C、D的化学式:
A:________,B:________C:________D:________。