在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。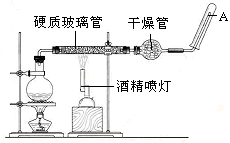
请回答该实验中的问题。
(1)写出该反应的反应方程式: ;
(2)实验前必须进行的操作是 。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是 烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
(4)酒精灯和酒精喷灯点燃的顺序是
(5)干燥管中盛装是的物质是 ,作用是 。
(6)试管中收集气体是 ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 。
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化,实验时必须使用铁屑、6 mol/L的硫酸;其他试剂任选。
填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中 应预先加入的试剂是________,A中反应的离子方程式为____________________________________________________。
应预先加入的试剂是________,A中反应的离子方程式为____________________________________________________。
(2)实验开始时应先将活塞D_____,其目的是____,在C中收集到的气体主要是_____________________
(3)简述生成Fe(OH)2的操作过程______________________________________________
(4)拔掉装置B中的橡胶塞,使空气进入,写出有关反应的化学方程式________________
下列实验操作不正确的是 _。
| A.在催化剂存在的条件下,苯和溴水发生反应可生成无色、比水重的液体溴苯 |
| B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验 |
| C.醇中含有少量水可加入硫酸铜再蒸馏制得无水乙醇 |
| D.试管中先加入一定量浓硫酸,再依次加入适量冰醋酸、乙醇,然后加热制取乙酸乙酯 |
E.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动
F.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
G.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置、待液体分层后,滴加硝酸银溶液
(12分)(1)写出实验室由苯和浓硝酸反应制取硝基苯的化学
方程式:该反应属于反应。
(2)右图所示的实验装置图中存在哪些错误?请指正。
①;
②;
③。
(3)在试管中将两种浓酸混和的操作方法是。
(15分)“套管实验”是将一支较小的试管装入另一试管中,经组装来完成原来需要两只或更多试管进行的实验。因其有许多优点,近年来被广泛开发并应用于化学实验中。下面这个实验为“套管实验”,实验装置如下图,小试管中部有沾上无水硫酸铜粉末的脱脂棉。请观察实验装置,分析实验原理,并回答下列问题:
(1)整个实验过程中,能观察到的现象为
①烧杯A中________;②小试管中________;
③烧杯B中____________________________;
(2)实验结束时,在操作上要特别注意的问题是
____________________________________________________________________
(3)写出实验过程中发生反应的化学方程式
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题: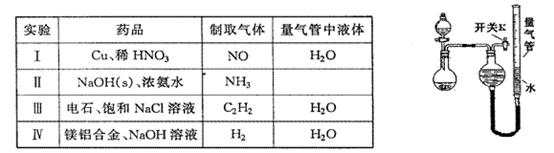
(1)如何检验如图所示装置的气密性:。
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?(填“可行”或“不可行”),原因是。
(3)实验Ⅲ烧瓶中发生反应的化学方程式是,打开开关K,产生的气体经验纯后点燃,现象是。
(4)实验Ⅱ中量气管中的液体最好是____(填字母编号,下同)
a.浓NaOH溶液 b.氨水 c.煤油 d.饱和氯化铵溶液
该实验剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有
(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温,②,③视线与凹液面最低处相平。
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 |
镁铝合金质量 |
量气管第一次读数 |
量气管第二次读数 |
| ① |
1.0g |
10.0mL |
346.3mL |
| ② |
1.0g |
10.0mL |
335.0mL |
| ③ |
1.0g |
10.0mL |
345.7mL |
根据上述数据,可计算出镁铝合金中铝的质量分数为__。