长途运输鱼苗时,常在水中加入少量过氧化钙(CaO2)固体。甲、乙两位同学发现往水中投入过氧化钙时产生气泡。
【提出问题】当把过氧化钙投入足量水中时,最终生成什么物质?
【进行猜想】甲同学:生成氧化钙和氧气; 乙同学:生成氢氧化钙和氧气。
你赞同的猜想是 (填“甲”或“乙”),其理由是 ;
【实验探究】
(1)打开右图装置中分液漏斗的活塞,控制滴加水速度,观察到
试管内有气泡产生。
① (填实验操作),
说明生成的气体是氧气。
②实验过程中,发现烧杯中有气泡出现,该现象说明 。
(2)请设计一个实验方案来验证乙同学猜想的生成物中有“氢氧化钙”:
| 实验步骤及操作方法 |
预期的实验现象 |
结论 |
| ①取少量过氧化钙放入试管中,加足量水,振荡, ② 。 |
①产生气泡, ② 。 |
过氧化钙和水反应产生的另一种物质是氢氧化钙 |
【问题讨论】
(1)运输鱼苗时,在水中加入少量过氧化钙的主要目的是 ;
(2)过氧化钙和水反应的化学方程式为 。
某研究性学习小组在学习金属铁的知识后,为了解铜及其常见化合物的性质,运用类比的思想提出了如下问题,并进行探究。请帮助完成下列有关研究并填写有关空白。
(1)【提出问题】
①铁能与稀硫酸反应产生氢气,铜能吗?铜与浓硫酸会发生反应吗?
②铁在潮湿的空气中易生锈,铜"生锈"需要什么条件?
③氧化铁能够被一氧化碳还原,氧化铜可以吗?氧化铜能直接转化为氢氧化铜吗?氧化铜还有哪些性质?
④有哪些途径可以由铜逐步转变为氢氧化铜?
(2)【查阅资料与问题解决】
①铜不能与稀硫酸发生置换反应,是因为在金属活动性顺序表中,铜排在之后。 铜能与浓硫酸发生反应,其反应方程式为:
↑此反应中化合价升高的元素是。
②铜在潮湿的空气中也能"生锈"形成铜绿,铜绿的主要成分为
。由此可以推测:铜"生锈"过程中,参与反应的物质有铜、氧气、水和。
③氧化铜可以在加热的条件下被一氧化碳等还原成铜,其与一氧化碳反应的化学方程式为;氧化铜不能与水反应生成氢氧化铜,但能与硫酸、盐酸等发生复分解反应形成相应的铜盐;在高温下,氧化铜能分解成砖红色的氧化亚铜(
)和氧气,反应的化学方程式为。
④由铜转化为氢氧化铜,从化学反应的原理看,可以是流程I:
也可以是流程II:
与流程I相比,流程Ⅱ的优点是和。 还可以有更多的流程。若流程Ⅲ与流程I相比,也是两步反应,但第一步与铜反应的试剂不同,则流程Ⅲ中第一步反应的化学方程式为。
某肉联厂在鲜肉表面涂抹白色粉末A以延长保质时间。小新进行了如下实验,探究化合物A的化学组成。
【定性研究】
| 步骤 |
实验操作 |
实验现象 |
| ① |
取样于试管中,加足量蒸馏水,振荡 |
样品消失,得到无色澄清溶液 |
| ② |
向步骤①所得溶液中滴加无色酚酞试液 |
溶液变红 |
| ③ |
向步骤②所得溶液中滴加稀盐酸至过量 |
产生无色无气味气体,溶液褪色 |
根据上述实验可初步推知,A是;
【定量研究】
为进一步探究A的化学组成,进行如下化学实验:
①将盛有292g质量分数为12.5%的稀盐酸的装置置于电子天平上(该装置可确保氯化氢和水蒸气不逸出);
②向装置中加入2.0gA,在天平读数不再变化时记录数据;
③重复②若干次日
④以mA(加入A的质量)为横坐标,以△m(溶液的增重)为纵坐标,绘得图。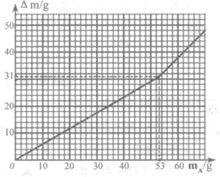
通过计算回答下列问题:
(1)实验中反应生成的气体的总质量为g;
(2)A中阳离子与阴离子质量的最简整数比为;
(3)A的化学式为。
某化学兴趣小组的同学往氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象.
【提出问题】氢氧化钠与盐酸是否发生了化学反应?
【查阅资料】酸与碱发生中和反应会放出热量.
【实验设计】甲、乙、丙三位同学分别设计了如下实验方案,请你帮他们完成实验报告.
| 同学 |
实验操作 |
现象 |
结论 |
| 甲 |
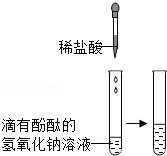 |
溶液由红色变成 | 氢氧化钠与盐酸发生了化学反应,反应的化学方程式为 |
| 乙 |
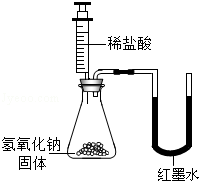 |
U型玻璃管中边的红墨水液面下降(所加稀盐酸的体积忽略不计) |
氢氧化钠与盐酸发生了化学反应 |
| 丙 |
用测定氢氧化钠溶液的pH,向其中滴加足量稀盐酸,再测定溶液的pH |
最后溶液的pH填"≥7"、"≤7"、"不变" |
氢氧化钠与盐酸发生了化学反应 |
【评价反思】你认为实验设计方案不合理的同学是,理由是.
【拓展延伸】另有一位同学向自己配制的氢氧化钠溶液中滴加酚酞试液时,溶液变红色,可是红色即可消失了,出现此意外情况的原因是(填以下序号).
| A. |
所用的酚酞试液是变质的 |
B. |
所用的氢氧化钠溶液浓度太小 |
C. |
氢氧化钠溶液吸收了空气中二氧化碳 |
我国第四套人民币硬币中使用到镍(
)、铜、铁等金属.某兴趣小组决定探究
、
、
的金属活动性顺序.
(1)【查阅资料】
镍能与盐酸或稀硫酸反应,生成可溶于水的正二价镍盐,并放出氢气.
①写出镍与盐酸反应的化学方程式.
②结合所学知识,(填"能"或"不能")直接比较出Ni、Fe的金属活动性强弱.
(2)【探究实验】(所用金属片均已用砂纸打磨.)
| 实验步骤 |
实验现象 |
实现结论 |
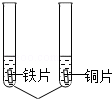 相同浓度的NiSO4 |
铁片表面有固体析出,铜片表面. |
三种金属活动性由强到弱的顺序为. |
(3)【迁移应用】
用镍片、硫酸亚铁溶液和溶液通过实验也能判断
、
、
的金属活动性顺序.
有一包白色固体样品,可能是碳酸钠、硫酸钡、氢氧化钠、氯化钡中的一种或几种。为探究其成分,小燕老师取用一定量样品,加足量水溶解,过滤得到白色沉淀甲和无色滤液乙。
写出上述操作中可能发生反应的化学方程式:。
过滤时用到玻璃棒,玻璃棒的作用是。
【探究活动一】 奋进小组探究白色沉淀甲的成分。
| 实验操作 |
实验现象 |
结论 |
| 取白色沉淀甲,滴加足量的稀硝酸 |
沉淀部分消失 |
白色沉淀甲中一定含有 |
【探究活动二】 智慧小组探究白色固体样品中可能含有,设计了如下实验。
| 实验操作 |
实验现象 |
结论 |
|
| 实验Ⅰ |
取适量无色滤液乙,加入碳酸钠溶液 |
无明显现象 |
无色滤液乙中一定不含 |
| 实验Ⅱ |
步骤①:取适量无色滤液乙,加入过量的溶液,过滤 |
生成白色沉淀 |
原白色固体样品中一定存在该物质 |
| 步骤②:取步骤①中的滤液,滴加溶液 |
【反思】 实验Ⅱ中步骤①加入过量试剂的目的是。
【结论】 通过两个小组的共同探究,得出了原白色固体样品含有的成分。