某研究性学习小组在学习金属铁的知识后,为了解铜及其常见化合物的性质,运用类比的思想提出了如下问题,并进行探究。请帮助完成下列有关研究并填写有关空白。
(1)【提出问题】
①铁能与稀硫酸反应产生氢气,铜能吗?铜与浓硫酸会发生反应吗?
②铁在潮湿的空气中易生锈,铜"生锈"需要什么条件?
③氧化铁能够被一氧化碳还原,氧化铜可以吗?氧化铜能直接转化为氢氧化铜吗?氧化铜还有哪些性质?
④有哪些途径可以由铜逐步转变为氢氧化铜?
(2)【查阅资料与问题解决】
①铜不能与稀硫酸发生置换反应,是因为在金属活动性顺序表中,铜排在之后。 铜能与浓硫酸发生反应,其反应方程式为:
↑此反应中化合价升高的元素是。
②铜在潮湿的空气中也能"生锈"形成铜绿,铜绿的主要成分为
。由此可以推测:铜"生锈"过程中,参与反应的物质有铜、氧气、水和。
③氧化铜可以在加热的条件下被一氧化碳等还原成铜,其与一氧化碳反应的化学方程式为;氧化铜不能与水反应生成氢氧化铜,但能与硫酸、盐酸等发生复分解反应形成相应的铜盐;在高温下,氧化铜能分解成砖红色的氧化亚铜(
)和氧气,反应的化学方程式为。
④由铜转化为氢氧化铜,从化学反应的原理看,可以是流程I:
也可以是流程II:
与流程I相比,流程Ⅱ的优点是和。 还可以有更多的流程。若流程Ⅲ与流程I相比,也是两步反应,但第一步与铜反应的试剂不同,则流程Ⅲ中第一步反应的化学方程式为。
为探究Al、Fe、Cu三种金属的活动性顺序,有甲、乙、丙三位同学设计了如下方案:
(1)甲同学将金属分别放入盛有盐酸的3支试管中。根据铜加入盐酸中无变化,
现象,判断出Al>Fe>Cu。
(2)乙同学只用一支试管,只取一次盐酸也能证明Al>Fe>Cu,他在盐酸中插入金属的顺序
是Fe。
(3)丙同学只调整了乙同学插入盐酸中金属的顺序,也能得到正确结论。丙同学调整金属
的顺序为。
【拓展应用】在CuCl2和AlCl3的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中加入盐酸,无明显现象,则滤液中一定含有的溶质是。
(7分)某化学兴趣小组的同学将一枚洁净的铁钉放入食盐水中(如图,装置气密性良好),一段时间后,进行观察。请你一起参与分析,并完成后续实验设计。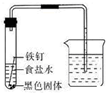
[观察现象]①装置中右侧导管中的液面升高。
②铁钉生锈,试管底部有黑色固体物质。
[提出问题]导管中液体为何升高?黑色固体物质又是什么?
[理论分析]小组同学根据已学过的知识分析得知,液面上升的原因是。
[猜想与假设]小组中的小明同学猜测该黑色固体可能含有:①Fe、②Fe2O3、③FeCl3、④C
四种物质。
[分析与验证]小组同学根据小明的四种猜测做了以下分析:
⑴小红同学认为不可能含有氯化铁,该结论得到小组同学的认可,理由是。
⑵小强同学认为一定含有碳,该结论也得到小组同学的认可,理由是。
⑶小组同学不能确定是否含有铁,请人帮他们设计方案进行确认:
实验中学的小春和小玲同学在张老师的指导下,对呼吸作用是否产生CO2气体进行探究。请你一同参与:
【提出问题】人呼出的气体中是否含有CO2气体?
【设计方案并实验】
小春:在试管中加入2 mL蒸馏水,用玻璃导管向其中吹气,未发现明显现象。
小玲:在试管中加入2 mL澄清石灰水,用玻璃导管向其中吹气,溶液变浑浊。
【解释与结论】小玲的实验结果证实了呼出的气体中含有CO2气体,其方案中的实验
原理可用符号表达式表示为___________________________________。
【评价与反思】小春的实验若继续进行,也能得到与小玲相同的结论。请你帮助设计后续方案:实验操作为_________________________________________________;实验现象是________________________________________________________。
有 和 混合物l8.6g。为测定其中 的质量,将固体溶于水,并逐渐加入稀硫酸至100g时,开始产生气体;再加入稀硫酸至100g时,不再产生气体,生成气体共4.4g(提示: )
(1)在图28中画出产生气体的质量与所加稀硫酸质量的关系曲线。
(2)求混合物中
的质量是多少?
(3)所用稀硫酸的溶质质量分数是多少?
在查阅资料时,小明得知
在高温条件下能与木炭反应生成
。他决定对该反应进行探究。
[提出问题]
与木炭在高温条件下反应是否生成
?
[实验探究]小胡设计了如图的实验方案,并进行实验。
(1)
中用石灰石与稀盐酸反应生成
,反应的化学方程式为。
(2)
中装有饱和碳酸氢钠溶液,其作用是除去
气体中混有的少量
气体。
中装有浓硫酸。其作用是。
(3)
中装入氢氧化钠溶液的作用是。
[实验结论]经检验
处的气体为
。结论:
在高温条件下与木炭反应生成了
。
[实验反思] (4)有同学对
装置作如下改进:在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中。改进后的优点是。
[实验拓展] (5)撤去
,按
顺序连接。然后
中用二氧化锰和过氧化氢溶液混合生成
,反应的化学方程式为。此时要检验该实验条件下
中木炭所发生反应的生成物,还需要补充和完善的实验是。