硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:
。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种: 。
(3)本实验的关键在于关闭气体流量计的时机,请问应当在什么时候关闭活塞A: 。
乙方案:实验步骤如以下流程图所示:
(4)写出步骤①中反应的化学方程式  。
。
(5)如何判断步骤②中沉淀是否完全的方法 。
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)
为 (用含有V、m的代数式表示)。
丙方案:将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,其余步骤与方案乙相同。
(7)你认为丙方案是否合理,说明理由:
。
天然气是重要的化石燃料和工业原料,其主要成分为甲烷。
(1)CO2气体排放会产生温室效应,将通入CO2碳化了的水在如图1所示的电解池阴极区进行电解,可以直接产生甲烷,加入硫酸钠为了增加导电性。
①写出电解时阴极的电极反应式 。
②电解时电解池采用阳离子交换膜,若采用阴离子交换膜会对电解产生的影响为 。
(2)将甲烷和硫反应可以制备CS2,其流程如下:
①反应1产生两种含硫的物质,则该反应方程式为 。
②反应当中,每有1molCS2生成时,需要消耗O2的物质的量为 。
③为了将含硫化合物充分回收,实验时需对反应1出来的气体分流,则进入反应2和反应3的气体气体关系为 。
(3)甲烷在高温下分解生成烃和氢气,若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图2所示,甲烷在高温下分解反应的化学方程式为 。
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)通入硫化氢的作用是:
①除去溶液中的Sn2+离子
②除去溶液中的Fe3+,其反应的离子方程式为 ;
操作II,在溶液中用硫酸酸化至pH=2的目的是 。
(2)操作IV的顺序依次为: 、 、过滤、洗涤、干燥。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
② 。
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取一定质量绿矾产品,配制成250.00mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。滴定时发生反应的离子方程式为:5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)。
①用硫酸酸化的0.01000 mol/LKMnO4溶液滴定时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 。
②判断此滴定实验达到终点的方法是 。
③若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有 。
某科研小组在900℃的空气中合成出化学式为La2Ca2MnOx的超导体材料,其中La以+3价存在。为确定x的值,进行如下分析:
步骤1:准确称取0.5250g超导体材料样品,放入锥形瓶中,加25.00mL0.06000mol•L-1Na2C2O4溶液(过量)和25mL6mol•L-1HNO3溶液,在60-70℃下充分摇动,约半小时后得到无色透明溶液A(该条件下,只有Mn元素被还原为Mn2+,Na2C2O4被氧化为CO2)。
步骤2:用0.02000mol•L-1KMnO4溶液滴定溶液A至终点,消耗10.00mL KMnO4溶液。
(1)步骤1反应后溶液中Mn2+的物质的量浓度为0.02000mol•L-1。常温下,为防止Mn2+形成Mn(OH)2沉淀,溶液的pH的范围为 [已知Mn(OH)2的Ksp=2.0×10-13]
(2)步骤2滴定终点的现象是 。
(3)步骤2滴定终点读数时俯视刻度,其他操作都正确,则所测x的值将 (填“偏大”、“偏小”或“不变”)。
(4)求x的值(写出计算过程)。
(本题14分)
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
请回答下列问题:
(1).氯化铁有多种用途,请用离子方程式表示下列用途的原理。
①氯化铁做净水剂______________________;
②用FeCl3溶液(32%~35%)腐蚀铜印刷线路板____________________________。
(2).吸收剂X的化学式为;氧化剂Y的化学式为________________。
(3).碱性条件下反应①的离子方程式为____________________________________。
(4).过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为
2KOH+Na2FeO4→K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因_________。
(5).K2FeO4在水溶液中易发生反应:4FeO42+10H2O 4Fe(OH)3+8OH+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用(填序号)。
4Fe(OH)3+8OH+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用(填序号)。
| A.H2O | B.稀KOH溶液、异丙醇 |
| C.NH4Cl溶液、异丙醇 | D.Fe(NO3)3溶液、异丙醇 |
(6).可用滴定分析法测定粗K2FeO4的纯度,有关反应离子方程式为:
①FeO42-+CrO2-+2H2O→CrO42-+Fe(OH)3↓+OH-
②2CrO42-+2H+→Cr2O72-+H2O
③Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O
现称取1.980 g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤,滤液定容于250 mL容量瓶中。每次取25.00 mL加入稀硫酸酸化,用0.1000 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中高铁酸钾的质量分数为。(答案用小数表示,保留3位小数)
(本题10分)
某兴趣小组同学在实验室用加热1-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如图所示装置,其中夹持仪器、加热仪器及冷却水管没有画出。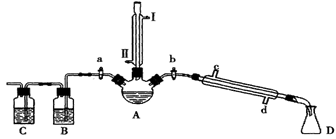
请根据实验步骤,回答下列问题:
(1).关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。
竖直冷凝管接通冷凝水,进水口是_____(填“I”或“Ⅱ”);竖直冷凝管的主要作用是________。
(2).理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物,已知B、C装置中为常见物质的水溶液。
B装置检验的物质是_________,写出C装置中主要的化学方程式:_______________。
(3).为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
| 物质 |
熔点/℃ |
沸点/℃ |
| 1-丁醇 |
-89.5 |
117.3 |
| 1-溴丁烷 |
-112.4 |
101.6 |
| 丁醚 |
-95.3 |
142.4 |
| 1-丁烯 |
-185.3 |
-6.5 |
请你补充下列实验步骤,直到分离出1-溴丁烷。
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③关闭_______,打开_______;
④接通冷凝管的冷凝水,使冷水从______处流入;
⑤迅速升高温度至_______℃,收集所得馏分。
(4).若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g1-溴丁烷,则1-溴丁烷的产率是_____。(答案用小数表示,保留2位小数)