在一支25 mL的酸式滴定管中盛入0.1 mo1·L-1 HCl溶液,其液面恰好在5 mL的刻度处。若把滴定管中的溶液全部放入锥形瓶中,然后以0.1 mo1·L-1NaOH溶液进行中和,则所需NaOH溶液的体积 ( )
| A.等于20mL | B.小于20mL | C.大于20mL | D.等于5mL |
8.某兴趣小组设计如图所示的微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是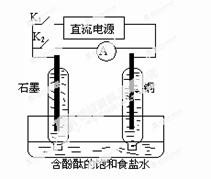
A.断开K2,闭合K1时,总反应的离子方程式为:2H+ + 2Cl-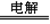 Cl2↑+H2↑ Cl2↑+H2↑ |
| B.断开K2,闭合K1时,石墨电极附近溶液变红 |
| C.断开K1,闭合K2时,铜电极上的电极反应为: Cl2+2e-=2Cl- |
| D.断开K1,闭合K2时,石墨电极作正极 |
7.下图是198K 时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是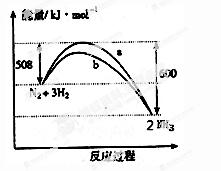
A.该反应的热化学方程式为:N2 + 3H2 2NH3, △H = -92kJ·mol-1 2NH3, △H = -92kJ·mol-1 |
| B.a曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂, 该化学反应的反应热改变 |
| D.在温度、体积一定的条件下, 通入lmol N2和3molH2反应后放出的热量为Q1kJ, 若通入2molN2和6molH2反应后放出的热量为Q2kJ 则184>Q2 >2Q1 |
6.下列关于反应热的说法正确的是
| A.当△H为“一”时,表示该反应为吸热反应 |
B.已知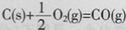 的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol 的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol |
| C.反应热的大小取决于反应物所具有总能量和生成物所具有总能量的相对大小 |
| D.反应热不但与反应体系的始态和终点状态有关,而且与反应的途径也有关 |
5.下列反应中,属于吸热反应的是
| A.食物的腐败 | B.铝与稀盐酸反应 |
| C.二氧化碳与碳反应生成一氧化碳 | D.甲烷在氧气中的燃烧 |
4.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是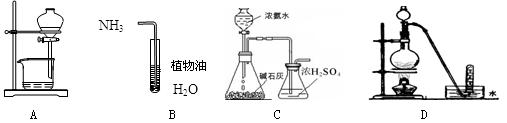



| A.放出碘的四氯化碳溶液 | B.吸收NH3 |
| C.制取氨气 | D.铜与浓硝酸反应制NO2 |