7.下图是198K 时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是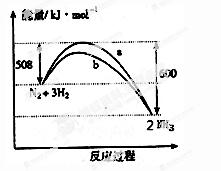
A.该反应的热化学方程式为:N2 + 3H2 2NH3, △H = -92kJ·mol-1 2NH3, △H = -92kJ·mol-1 |
| B.a曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂, 该化学反应的反应热改变 |
| D.在温度、体积一定的条件下, 通入lmol N2和3molH2反应后放出的热量为Q1kJ, 若通入2molN2和6molH2反应后放出的热量为Q2kJ 则184>Q2 >2Q1 |
下列混合物能用分液法分离的是
| A.乙醇与乙酸 | B.苯和硝基苯 |
| C.乙酸乙酯和Na2CO3溶液 | D.乙醛与水 |
下列化学用语中,书写或说法正确的是
| A.乙烯的结构简式:CH2CH2 |
| B.乙醇含有的官能团是—OH,带一个单位负电荷 |
C.丙烷的球棍模型为 |
| D.乙酸的分子式:C2H4O |
下列属于纯净物的是
| A.汽油 | B.煤 | C.乙烯 | D.石油裂解气 |
下列属于加成反应的是
| A.己烯使酸性高锰酸钾溶液褪色 |
| B.将苯滴入溴水中,振荡后水层接近无色。 |
| C.乙烯使溴水褪色 |
| D.甲烷与氯气混合光照一段时间后黄绿色消失。 |
下列说法中正确的一组是
| A.H2和D2互为同位素; |
B.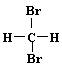 和 和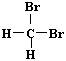 互为同分异构体; 互为同分异构体; |
| C.正丁烷和异丁烷是同系物; |
D.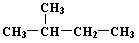 和 和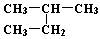 是同一种物质 是同一种物质 |