下列溶液中微粒浓度关系 一定正确的是
一定正确的是
| A.将水加热到120℃,pH=6:c(OH-)< c(H+) |
| B.醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO-)> c(Na+) |
| C.0.l moI·L-1的硫酸铵溶液中:c(NH4+)> c(SO42-)> c(H+) |
| D.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)= c(H+) |
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如右。该电池工作时,下列说法正确的是( )
| A.Mg电极是该电池的正极 |
| B.H2O2在石墨电极上发生氧化反应 |
| C.石墨电极附近溶液的pH增大 |
| D.溶液中Cl-向正极移动 |
用惰性电极电解CuSO4和NaCl的混合溶液,开始时阴极和阳极上析出的物质分别是( )
| A.H2和Cl2 | B.Cu和Cl2 | C.H2和O2 | D.Cu和O2 |
关于如图所示的原电池,下列说法正确的是()
| A.电子从锌电极通过电流表流向铜电极 |
| B.盐桥中的阴离子向硫酸铜溶液中迁移 |
| C.取出盐桥后,电流计的指针仍发生偏转 |
| D.铜电极上发生的电极反应是2H++2e﹣═H2↑ |
某反应过程中体系的能量变化如图所示,下列说法错误的是( )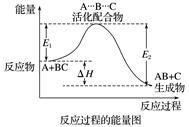
A.反应过程可表示为 |
| B.E1为反应物的总能量与过渡态的能量差,称为正反应的活化能 |
| C.正反应的热效应ΔH=E1-E2<0,所以正反应为放热反应 |
| D.此图中逆反应的热效应ΔH=E1-E2<0,所以逆反应为放热反应 |
对于:2C4H10(g)+13O2(g)═ 8CO2(g)+10H2O(l);△H=﹣5800kJ/mol的叙述中不正确的是( )
| A.该反应的反应热为△H=﹣5800kJ/mol,是放热反应 |
| B.该反应的△H与各物质的状态有关,与化学计量数也有关 |
| C.该式的含义为:25℃、101kPa下,2molC4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ |
| D.该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800kJ/mol |