“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟。以下叙述错误的是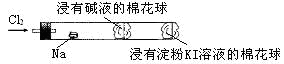
| A.钠着火燃烧产生苍白色火焰 |
| B.反应生成的大量白烟是氯化钠晶体 |
| C.管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 |
| D.管右端浸有淀粉KI溶液的棉球颜色变化可判断氯气是否被碱液完全吸收 |
在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是
| A.范德华力、范德华力、范德华力 |
| B.用范德华力、范德华力、共价键 |
| C.范德华力、共价键、共价键 |
| D.共价键、共价键、共价键 |
下列变化需克服相同类型作用力的是
| A.碘和干冰的升华 | B.硅和C60的熔化 |
| C.氯化氢和氯化钾的溶解 | D.溴和汞的气化 |
ToC时,在一固定容积的密闭容器中发生反应:A(g)+B(g) C(s)∆H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s)∆H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
A.ToC时,该反应的平衡常数值为4
B.c点没有达到平衡,此时反应向逆向进行
C.若c点为平衡点,则此时容器内的温度高于ToC
D.ToC时,直线cd上的点均为平衡状态
下列说法正确的是
| A.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小 |
| B.根据CO2通入漂白粉水溶液中,溶液先变浑浊后澄清,推断SO2通入也有同样现象 |
| C.向1 mL浓度均为0.05 mol·L-1的NaCl、NaI混合溶液中滴加2滴0.01 mol·L-1的AgNO3溶液,振荡,沉淀呈黄色。结论:Ksp(AgCl)<Ksp(AgI) |
| D.将Fe(NO3)2晶体溶于稀硫酸,滴加KSCN溶液,通过观察溶液变红确定硝酸亚铁晶体已被氧化 |
某溶液可能含有Na+、Fe3+、Br﹣、I﹣、HCO3﹣、SO32﹣、NO3﹣等离子①向该溶液中滴加氯水,无气泡产生,溶液呈橙色;②向橙色溶液中加入BaCl2溶液产生白色沉淀;③向橙色溶液中滴加淀粉溶液未变蓝,则在该溶液中肯定存在的离子组是
| A.Na+、I﹣、SO32﹣ | B.Na+、Br﹣、SO32﹣ |
| C.Fe3+、Br﹣、NO3﹣ | D.Na+、Br﹣、NO3﹣ |