有下列三个氧化还原反应:
① 2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2;
②2FeCl2 + Cl2 = 2FeCl3;
③ 2KMnO4 + 16HCl =" 2KCl" + 2MnCl2 + 5Cl2↑+ 8H2O。
若某溶液中有Fe2+、I-、Cl-共存,要除去I-而不使Fe2+和Cl-的量减少,可加入的试剂是
| A.Cl2 | B.KMnO4 | C.FeCl3 | D.HCl |
下列反应的离子方程式正确的是()
| A.硫酸铁溶液与氢氧化钡溶液反应:Fe3++3OH-====Fe(OH)3↓ |
| B.硫化钠溶液与氯化铁溶液反应:2Fe3++3S2-====Fe2S3 |
C.过量的铁与很稀的硝酸溶液反应无气体放出:4Fe+10H++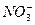 ====4Fe2++3H2O+ ====4Fe2++3H2O+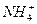 |
| D.硫化氢气体通入氯化亚铁溶液:H2S+Fe2+====FeS↓+2H+ |
铁有多种价态,将14.4 g草酸亚铁(FeC2O4)与空气隔绝加热分解,最终得到7.2 g铁的氧化物,则该铁的氧化物是()
| A.Fe3O4 | B.Fe2O3 | C.FeO | D.FeO和Fe3O4 |
在由Fe、FeO和Fe2O3组成的混合物中加入100 mL 2 mol·L-1的盐酸,恰好使混合物完全溶解,并放出448 mL气体(标准状况),此时溶液中无Fe3+存在。则下列判断正确的是
()
| A.混合物中三种物质反应所消耗的盐酸的物质的量之比为1∶1∶3 |
| B.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多 |
| C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多 |
| D.反应后所得溶液中的Fe2+与Cl-的物质的量之比为1∶3 |
在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀。工业上制CuCl2是将浓盐酸用蒸汽加热到80 ℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法正确的是( )
| A.加入纯Cu将Fe2+还原 |
| B.向溶液中加入(NH4)2S使Fe2+沉淀 |
| C.直接加入水加热使杂质离子水解除去 |
| D.在溶液中通入Cl2,再加入CuO粉末调节pH为4~5 |
某人设想利用①3FeCl2+4H2O====Fe3O4+6HCl+H2
②Fe3O4+1.5Cl2+6HCl====3FeCl3+3H2O+0.5O2③3FeCl3====3FeCl2+1.5Cl2
这三个反应(反应条件均略去)的联合与循环,来生产能解决环境和能源问题的某种气体,该气体是()
| A.O2 | B.Cl2 |
| C.HCl | D.H2 |