下表是某地市场销售的一种“加碘食盐”包装袋上的部分文字说明。
| 配 料 |
氯化钠、碘酸钾 |
| 含碘量 |
(20mg~40mg)/1kg |
| 保质期 |
18个月 |
| 食用方法 |
勿长时间炖炒 |
| 贮藏指南 |
避热、防潮 |
(1)已知碘在碘酸钾中的化合价为+5,1mol碘酸钾中共含5mol原子,则碘酸钾的化学式为____________________________________________________。
(2)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式:
_________+_________KI+_________H2SO4—_________K2SO4+_________I2+_________H2O
(3)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是__________________________。
(4)由食用方法和贮藏指南可推测碘酸钾的化学性质之一是_____________。
(5)用单质碘与氯酸钾发生置换反应可制得碘酸钾,该反应的化学方程式为_____________。
(1)把下列式子改成氧化物形式
①正长石(KAlSi3O8)
②蛇纹石(H4Mg3Si2O9)
(2)写出下列物质间的关系:红磷与白磷,
35Cl和37Cl
(3)写出除去括号中杂质的方法:
碳酸钠固体(碳酸氢钠晶体)
SiO2固体 (CaO)
CO2 (SO2 )
(4)写出稀硝酸与金属银在加热条件下反应的离子方程式:
将PbO2放入浓盐酸中会产生Cl2,此反应的化学方程式为:
(5)标准状况下,在三个容积相同的干燥的烧瓶中,甲瓶装入干燥纯净的NH3,乙瓶装入含四分之一体积空气的HCl,丙瓶装入NO2和O2(体积比为4:1),以水为溶剂作喷泉实验。实验结束后三个烧瓶中溶液的物质的量浓度之比为,丙瓶中发生反应的总化学方程式为
图Ⅰ是化学实验室中常用制备、干燥气体的部分仪器装置。某学校同学利用中学常用试剂及仪器设计下列实验。
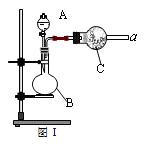
(1)图Ⅰ中仪器B的名称:_______________________。
(2)①同学甲利用图Ⅰ装置制备并收集干燥的NO2气体,请在方框内画出用集气瓶收集NO2的装置图(含尾气处理装置)。②B中发生反应的离子方程式为________________。
(3)同学乙利用图Ⅰ装置通过称量反应前后C的质量,确定Na2CO3和NaCl固体混合物中Na2CO3的质量。A中加入稀硫酸,B中加入Na2CO3和NaCl固体混合物,C中加入碱石灰。该装置存在较多缺陷,从而导致实验误差较大,请你说出其中的两点缺陷:
①______________________________________________________________________;
②______________________________________________________________________。
(4)同学丙利用图Ⅰ装置制取氨气和氧气的混合气体,并且利用图Ⅱ装置验证氨的某些性质。A中加入浓氨水,C中加入碱石灰,E内放置催化剂(铂石棉),按气流方向a→b→c→h连接各仪器。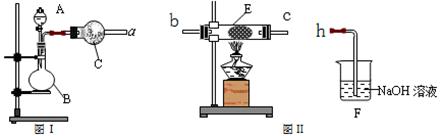
①B内需加入固体试剂的名称为____________________,B中能产生氨气和氧气混合气体的原因是_______________________________________________________________。
②实验中观察到E内有红棕色气体出现,证明氨气具有_________性,E中发生反应的两个化学方程式为:____________________________和2NO + O2 ==2NO2。
( 12分) A、B、C、D四种元素原子核电荷数依次增大(均小于20),其单质及相应的化合物能发生如下反应关系: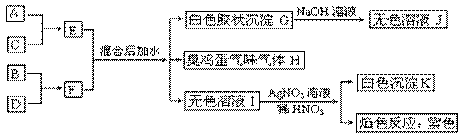
(1)写出四种元素元素符号:A、____B、____C、____D、____。
(2) F的电子式:_________________。
(3)写出E、F混合后加水的离子方程式:_________________________________。
(4)写出G→J的离子方程式:_________________________________。
(5)写出C单质与H水溶液反应的离子方程式:_____________________________。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2 (g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(2)一氧化碳在高温下与水蒸气反应的方程式为:CO+H2O=CO2+H2。已知部分物质燃烧的热化学方程式如下: 2H2 (g) + O2(g) = 2H2O(l);△H=-571.6kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) ;△H=-566kJ·mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CO和水蒸气在高温催化剂下反应的热化学方程式。
(3)在25℃下,向浓度为0.1 mol·L-1的AlCl3溶液中逐滴加入氨水,生成该沉淀的离子方程式为______________________________。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式。
(5)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=1的H2SO4溶液VaL与pH=11的NaOH溶液VbL混合,若所得混合液为中性,则
Va︰Vb=。
(6)在25℃下,将a mol·L-1的氨水 与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);
与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);
如图所示,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。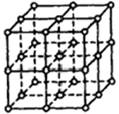
(1)晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有个。
(2)已知食盐晶体的密度为2.2g/cm3,阿伏加德罗常数为6.02×1023mol-1。食盐晶体中两个距离最近的钠离子中心间的距离为cm。计算过程如下:
。