氢化钙固体登山运动员常用的能源提供剂。某兴趣小组长拟选用如下装置制备氢化钙。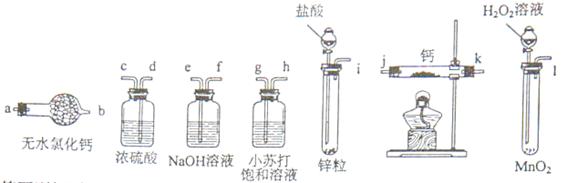
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为________(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞_________(请按正确的顺序填入下列步骤的标号)。
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此判断,上述实验确有CaH2生成。
__________________
①写出CaH2与水反应的化学方程式 ___________________
②该同学的判断不正确,原因是_________________
(4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象
(12分)某无色溶液中含有K+、SO32-、SO42-、Cl、OH-,检验溶液中除OH-外其他阴离子的步骤如下图所示。
回答下列问题:
(1)填写试剂的化学式①②⑤。
(2)试剂④可能是(填选项字母)。
| A.石蕊试液 | B.硫酸铜溶液 | C.溴水 | D.品红溶液 |
(3)若试剂④是酸陛KmnO4溶液,写出气体E与酸性KmnO4溶液反应的离子方程式
。
(4)加过量试剂③的目的是。
(5)试剂②能否用试剂③代替(填“能”或“否”),理由是?
。
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为____________;
为了吸收该反应中产生的尾气,可选择的最佳装置是_______________。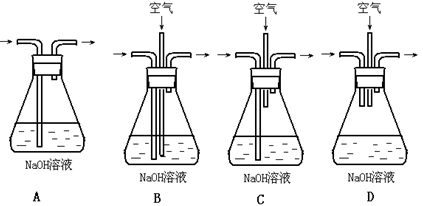
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案1:以空气为氧化剂。将铜粉在仪器N中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,再通入空气或氧气,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部转化为Fe(OH)3沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
(已知:Ksp[Cu(OH)2]≈10-22, Ksp[Fe(OH)3]≈10-38)
请回答下列问题:
①方案1中的N仪器名称是______________。
②为了使铁元素全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是________________________。
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3 E.Fe2(SO4)3 |
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因___________________________________ _____________________________________。
实验室常利用甲醛法测定某(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO = 4H+ +(CH2)6N4+6H2O,然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤①用电子天平准确称取样品1.5000 g。
步骤②将样品溶解并冷却后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤③移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛,摇匀、静置5min,加入2滴酚酞试液,用NaOH标准溶液滴定到终点。重复步骤③操作2次。
(1)根据步骤③填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数将(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积将
(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由色变为色,半分钟内不退色。
⑤滴定后俯视读数,测得样品中氮的质量分数将(填“偏高”、“偏低”或“无影响”)。
(2)滴定结果如下表所示:
| 滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
25.00 |
1.02 |
21.04 |
| 2 |
25.00 |
2.00 |
22.00 |
| 3 |
25.00 |
0.20 |
20.21 |
若NaOH标准溶液的浓度为0.1000 mol·L-1,则该样品中氮的质量分数为。(保留两位小数)
制备溴苯的实验装置如右图所示,回答下列问题:
(1)该反应装置中仪器A的名称为。反应开始前已向仪器A中加入的固体药品是铁粉,而装在左侧分液漏斗中的液体药品是。
(2)冷凝管B有上、下两口,冷却水应从口进入
(3)导管口不能插入锥形瓶中的液面之下,其原因是;
(4)右侧分液漏斗中的物质在反应时加入A中(填写反应前、反应中或者反应后)。用离子方程式表达其作用是。
(5)反应结束向锥形瓶中的液体中加入硝酸酸化的硝酸银溶液,可见到现象是。
(6)该过程可以如下表述:3Br2+2Fe=2FeBr3;Br2+FeBr3=FeBr4-+Br+(不稳定); +Br+→[
+Br+→[ ];[
];[ ]+FeBr4-→
]+FeBr4-→ +HBr+FeBr3;
+HBr+FeBr3;
由上反应可知: +Br2→
+Br2→ +HBr中的催化剂为()
+HBr中的催化剂为()
A Fe B FeBr3 C Br+ D FeBr4-
用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如上图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)烧杯间填满碎泡沫塑料的作用是;
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?(填“能”或“不能”),其原因是;
(3)实验时氢氧化钠溶液的浓度要用0.55mol/L的原因是;
实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),若实验操作均正确,则所求中和热(填“相等”或“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:。