(本题8分)异丙苯(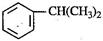 ),是一种重要的有机化工原料。
),是一种重要的有机化工原料。
根据题意完成下列填空:
(1)由苯与2-丙醇反应制备异丙苯属于 反应;由异丙苯制备对溴异丙苯的反应试剂和反应条件为 。
(2)异丙苯有多种同分异构体,其中一溴代物最少的芳香烃的名称是 。
(3)α-甲基苯乙烯(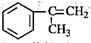 )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到。写出由异丙苯制取该单体的另一种方法 (用化学反应方程式表示)。
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到。写出由异丙苯制取该单体的另一种方法 (用化学反应方程式表示)。
(4)耐热型ABS树脂由丙烯腈(CH2=CHCN)、1,3-丁二烯和α-甲基苯乙烯共聚生成,写出该树脂的结构简式 (不考虑单体比例)。
按要求写出有关氧化还原反应的化学方程式.
(1)是化合反应,也是氧化还原反应_________.
(2)是分解反应,也是氧化还原反应_________.
(3)有金属单质Ag生成的置换反应__________.
(4)不属于四种基本反应类型的氧化还原反应__________.
现有标准状况下的35.5g Cl2,回答下列问题:
(1)其体积约为__________L;
(2)将其与H2在点燃条件完全化合生成HCl,此反应的化学方程式为:__________;
(3)此反应中电子转移的数目约为__________个;
(4)生成的HCl的物质的量为__________mol
(5)将生成的HCl全部溶于水配成溶液,则完全中和这些HCl需要浓度为10mol/L NaOH的体积为__________mL.
有一瓶无色澄清溶液,其中可能含有Na+、Mg2+、Ba2+、Cl-、SO42-、CO32-离子。现进行以下实验:
①用pH试纸检验溶液,发现溶液呈强酸性;
②取部分溶液逐滴加入NaOH溶液,使溶液由酸性变成碱性,无沉淀产生;
③取少量②中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
(1)根据上述事实确定:
该溶液中肯定存在的离子有 ;
肯定不存在的离子有 ;
可能存在的离子有 。
(2)写出③中发生反应的离子方程式 。
(3)检验该溶液中所含的阴离子的试剂是 (填名称)。
在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 |
质量(g) |
摩尔质量(g·mol-1) |
| 蔗糖 |
25.00 |
342 |
| 硫酸钾 |
3.48 |
174 |
| 阿司匹林 |
0.17 |
180 |
| 高锰酸钾 |
1.58 |
158 |
| 硝酸银 |
0.02 |
170 |
(1)下列“鲜花保鲜剂”的成分中,属于电解质的是__________。
A.蔗糖B.硫酸钾C.高锰酸钾D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为 。
(3)配制上述“鲜花保鲜剂” 用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少 , (填写所缺仪器的名称)。
(4)配制溶液时有以下几个操作:
①溶解 ②摇匀 ③洗涤 ④冷却 ⑤称量 ⑥转移溶液 ⑦定容,
正确的操作顺序是 (填序号)。
(5)若定容时俯视容量瓶刻度线,会使所配溶液浓度 (填偏大、偏小、不变)。
(1)某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液。
其反应原理为(用离子方程式表示): 。
(2)在实验室里用浓盐酸与高锰酸钾反应来制取少量的氯气,反应的化学方程式为:
2KMnO4+16HCl(浓) ═ 2KCl+ 2MnCl2+5Cl2↑+8H2O
反应物中,氧化剂是 ;化合价升高的元素是________。
反应中HCl的作用是 。
(3)某同学帮助水质检测站配制230 mL 0.1 mol·L-1 NaOH溶液以备使用:该同学应选用 (仪器名称)称取NaOH固体________g;
(4)取上述配制的NaOH溶液 mL才能与0.224 L氯气(STP)恰好完全反应。