(14分)Ⅰ.2011年11月28日至12月9日,联合国气候变化框架公约第17次缔约方会议在南非德班召开,随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25 mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O (g)的浓度随时间变化如图所示:
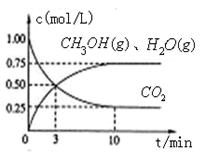
①写出该工业方法制取甲醇的化学反应方程式 。
②从反应开始到平衡,氢气的平均反应速率v (H2)= 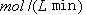 。
。
③该条件下CO2的转化率为 。当温度降低时CO2的转化率变大,则该反应 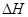 0(填“>”“<”或“=”)。
0(填“>”“<”或“=”)。
④下列措施中能使n(CH3OH)/n(CO2)增大的是 。
| A.升高温度 | B.充入氮气 | C.将水蒸气从体系中分离 | D.用更有效的催化剂 |
(2)选用合适的合金作为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极的电极方程式为 。
Ⅱ.研究NO2 、SO2 、CO等大气污染气体的处理具有重要意义。其中氮元素有着多变价态和种类多的化合物,它们在工农业生产、生活中发挥着重要的作用。完成下列问题:
(1)已知:2SO2(g) + O2(g) 2SO3(g) ΔH=" —196.6" kJ·mol―1
2SO3(g) ΔH=" —196.6" kJ·mol―1
2NO(g) + O2(g) 2NO2(g) ΔH= —113.0 kJ·mol―1
2NO2(g) ΔH= —113.0 kJ·mol―1
则反应NO2(g) + SO2(g) SO3(g) + NO(g) 的ΔH= 。
SO3(g) + NO(g) 的ΔH= 。
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,
①下列能说明反应达到平衡状态的是 (填序号) 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.相同时间内,每消耗1 molNO2的同时消耗1 mol SO3
②当测得上述反应平衡时NO2与SO2体积比为1: 6,则平衡常数K= 。
用碳棒作电极,在H+、Na+、Cu2+、Ag+、Cl-、NO3-、SO42-等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
(1)当阴极放出H2,阳极放出O2时,电解质是;
(2)当阴极析出金属,阳极放出O2时,电解质是;
(3)当阴极放出H2,阳极放出Cl2时,电解质是;
(4)通过电子的物质的量与阴极析出的金属、阳极析出的气体的物质的量之比为4∶2∶1时,电解质的化学式是。
已知1mol CO气体完全燃烧生成CO2气体,放出283kJ热量,1mol氢气完全燃烧生成液态水放出286kJ热量,1mol CH4气体完全燃烧生成CO2气体和液态水放出890kJ热量,
(1)写出H2完全燃烧生成液态水的热化学方程式________________________________;
(2)若1mol CH4气体完全燃烧生成CO2气体和水蒸汽,放出热量_______890kJ(填“ =”、“>”、“<”)
(3)若将a mol CH4,CO,H2混合气体完全燃烧,生成CO2气体和液态水,则放出热量(Q)
的取值范围是______________________________________;
(4)若将a mol CH4,CO,H2混合气体完全燃烧,生成CO2气体和液态水,且CO2和H2O物
质的量相等,则放出热量(Q)的取值范围是________________________________。
(5分)下列物质①NaHC03②氢氧化钠溶液 ③乙醇④ C12⑤HNO3⑥S02
其中属于混合物的是_______;属于酸的是_______;属于酸性氧化物的是属于盐的是_______;属于单质的是_______ (填序号)。
(8分)2molCO2的质量为 g,含分子数约为个,在标准状况下所占有的体积约为L,含氧原子的物质的量为mol。
(4分)小苏打是厨房里的常见物质,是发酵粉的主要成分,请写出小苏打的化学
式,若食盐中可能混入了少量小苏打,用下列厨房中的进行检验。
| A.白酒 | B.食醋 | C.酱油 | D.白糖 |