(本题12分)化合物M是一种治疗心脏病药物的中间体,以A为原料的工业合成路线如下图所示。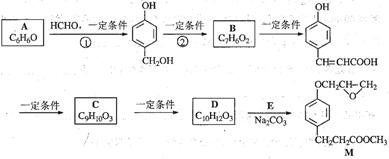
已知:RONa+ R’X→ROR’+ NaX
根据题意完成下列填空:
(1)写出反应类型。反应① 反应②
(2)写出结构简式。A C
(3)写出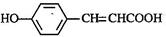 的邻位异构体分子内脱水产物香豆素的结构简式 。
的邻位异构体分子内脱水产物香豆素的结构简式 。
(4)由C生成D的另一个反应物是 ,反应条件是 。
(5)写出由D生成M的化学反应方程式 。
(6)A也是制备环己醇(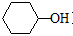 )的原料,写出检验A已完全转化为环己醇的方法。
)的原料,写出检验A已完全转化为环己醇的方法。
(6分)随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
试用 ══
══ ↑的反应设计原电池。
↑的反应设计原电池。
(1)原电池中使用的电解质溶液是 ;
(2)写出电极反应式:
负极: ,
正极: ;
(3)在方框中画出此原电池的图,并标出电极材料的名称。
由原子序数依次增大的五种短周期元素A、B、C、D、E,已知A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素最高价氧化物的水化物与其氢化物反应生成一种盐;A、B、C、E四种元素分别都能与D元素形成原子个数比不相同的多种常见化合物,回答下列问题:
(1)B在周期表中的位置是 ,C元素的单质的电子式 。
(2)写出同时含A、B、C、D四种元素的一种盐的化学式 。
(3)E与D形成的一种化合物与BD2发生氧化还原反应,该反应的化学方程式为 。
(4)用A和D两元素组成的单质可以制成一种燃料电池,电池中装有浓KOH溶液。用多孔的惰性电极浸入浓KOH溶液中,两极均有特制的防止气体透过的隔膜,在一极通入A的单质,另一极通入D的单质。则该电池正极的电极反应式为 。
(5)化合物C2A4和C2D4的液体曾被用作火箭推进剂,燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染。已知1mol C2A4和C2D4完全反应生成两种气体时放出热量516.8KJ,则该反应的热化学方程式为 。
从能量的变化和反应的快慢等角度研究反应: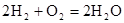 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
| A.使用催化剂 | B.适当提高氧气的浓度 |
| C.适当提高反应的温度 | D.适当降低反应的温度 |
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。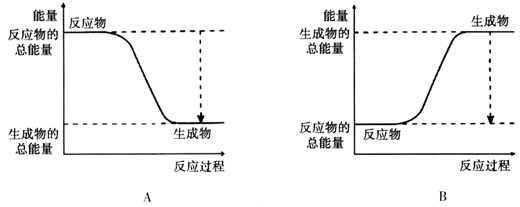
(3)从断键和成键的角度分析上述反应中能量的变化。
【资料】①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能。
②化学键的键能:
| 化学键 |
H—H |
O=O |
H—O |
键能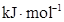 |
436 |
496 |
463 |
请填写下表:
| 化学键 |
填“吸收热量” 或“放出热量” |
能量变化 |
|
| 拆开化学键 |
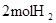 中的化学键 中的化学键 |
_______________ |
_______________ |
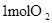 中的化学键 中的化学键 |
|||
| 形成化学键 |
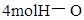 键 键 |
_______________ |
_______________ |
| 总能量变化 |
_______________ |
_______________ |
|
(4)氢氧燃料电池的总反应方程式为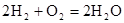 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的―1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1)B元素在元素周期表中的位置是 ____________族。
(2)画出D元素的原子结构示意图____________。
(3)与E的氢化物分子所含电子总数相等的分子是_________(举一例、填化学式),离子是____________(举一例、填电子式)。
(4)A与C形成的化合物中含有的化学键的类型是____________。
(5)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式是__________________________________________。