(1)甲醇是一种重要的化工产品,可利用甲醇催化脱氢制备甲醛。甲醛与气态甲醇转化的能量关系如图所示。
反应过程中的能量关系
①甲醇催化脱氢转化为甲醛的反应是________(填“吸热”或“放热”)反应。
②过程Ⅰ与过程Ⅱ的反应热是否相同?____________原因是__________________________________。
③写出甲醇催化脱氢转化为甲醛的热化学反应方程式________________________________。
(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+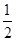 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是________。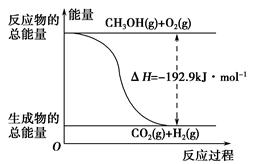
| A.CH3OH转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物的总能量 |
C.根据②推知反应:CH3OH(l)+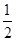 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
| D.反应②的能量变化如图所示 |
某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中 除Cu(OH)2外还有碱式硫酸铜【可表示为xCuSO4.yCu(OH)2】.为了加以验证,小组成员进行了如下实验:
除Cu(OH)2外还有碱式硫酸铜【可表示为xCuSO4.yCu(OH)2】.为了加以验证,小组成员进行了如下实验: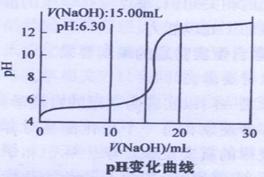
①分别配置50mL物质的量浓度均为0.100mol/L的CuSO4溶液和NaOH溶液;
②准确量取10mL CuSO4溶液倒入50ml烧杯中
③向烧杯中匀速加入0.100 mol/L的NaOH溶液,并每加入1.00mlNaOH溶液用pH计测一次混合溶液的pH
④当滴入NaOH溶液的体积达到30ml时停止实验,并绘制出向CuSO4溶液中滴加NaOH溶液时PH变化曲线。如右图
请回答下列问题:
(1)配置溶液时需要使用烧杯、、等玻璃仪器;下列仪器中可用于向烧杯中加入NaOH溶液的仪器是
| A.胶头滴管 | B.酸式滴定管 | C.碱式滴定管 | D.量筒 |
(2)V(NaOH)在2.00ml~15.00ml之间时,溶液中产生绿色沉淀,并不断增加,经检测此沉淀为碱式硫酸铜。当V(NaOH)为15.00ml时,溶液PH为6.32(已知蒸馏水的PH为6.32),则可求得x=y=
(3)V(NaOH)在17.00ml~20.00ml之间时,溶液中出现蓝色沉淀,并不断增加。已知V(NaOH)为20.00ml时,溶液PH为12.25,则此时沉淀中(填“含”或“不含”)有碱式硫酸铜,请设计实验方案加以证明:
某研究性学习小组研究HNO3的氧化性,设计了如下实验:在盛有新配制的FeSO4溶液的试管中滴入2滴KSCN溶液,观察现象,然后再加入浓HNO3,溶液的颜色变红,但是将红色溶液放置一会儿则发现溶液由红色快速变为蓝色,并产生红棕色气体,这一奇特现象激起了同学们的好奇心与求知欲望,他们对此现象设计了探究性实验。
(1)甲同学认为是溶液中的Fe2+的干扰造成的,大家经过理性分析,认为可以排除Fe2+的干扰,理由是 。
(2)乙同学认为红色消失,说明Fe(SCN)3被破坏,红棕色NO2说明了某些离子与HNO3发生了氧化还原反应,推测可能是KSCN与HNO3作用。根据C、S、N的原子结构和共价键的相关知识推断SCN-的结构式为。
(3)根据乙同学的,观点,设计了实验方案1,往浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色 ,突然剧烈反应产生大量气泡,放出红棕色气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN溶液变为浅蓝色,最后变为无色。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种非极性气体;向反应后的溶液中加入BaCl2溶液产生白色沉淀。(此过程中溶液颜色变化不必细究),请写出向浓HNO3中滴入KSCN离子的方程式:。
,突然剧烈反应产生大量气泡,放出红棕色气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN溶液变为浅蓝色,最后变为无色。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种非极性气体;向反应后的溶液中加入BaCl2溶液产生白色沉淀。(此过程中溶液颜色变化不必细究),请写出向浓HNO3中滴入KSCN离子的方程式:。
(4)丙同学认为SCN-的性质 还可进一步探究,设计了方案2,向Fe(SCN)3中分别滴加过量的氯水.溴水,溶液的红色均消失变为黄色,而加入过量的碘水时溶液的颜色基本不变。丙同学的设计意图是。
(5)通过本次探究,可知用SCN-间接检验Fe2+时应注意。
纳米级四氧化三铁是应用最为广泛的软磁性材料之一,常用作记录材料,磁流体材料,催化剂,电子材料等。其在生物技术领域和医学领域也有很好的应用前景。共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图示:
请回答下列问题:(1)实验室保存溶液A时,需加入。
(2)为了得到较纯的纳米Fe3O4,FeSO4·7H2 O 和 FeCl3·6H2O的物质的量之比最好应为,在此条件下,检验铁元素是否沉淀完全的实验操作是。
O 和 FeCl3·6H2O的物质的量之比最好应为,在此条件下,检验铁元素是否沉淀完全的实验操作是。
(3)写出制备纳米Fe3O4的离子反应方程式。
(4)共沉淀法的主要不足是:①得到的Fe3O4纳米粒子间存在团聚现象
②。
(5)磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性,下列关于纳米Fe3O4磁硫体的说法中不正确的是:。
| A.纳米Fe3O4磁硫体分散系属于溶液。 |
B.纳米Fe3O4磁硫体可 以通过渗析法得到提纯。 以通过渗析法得到提纯。 |
| C.当一束可见光通过该磁硫体时会出现光亮的通路。 |
| D.纳米Fe3O4磁硫体比较稳定。 |
1 L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 |
H+NH4+Al3+K+ |
| 可能大量含有的阴离子 |
Cl-Br-I‑ClO‑AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(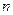 )与加入NaOH溶液的体积(
)与加入NaOH溶液的体积(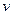 )的关系如右图所示。
)的关系如右图所示。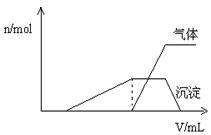
则该溶液中确定含有的离子有__ _____ __;
_____ __;
不能确定是否含有的阳离子有_______ ___,
要确定其存在可补充做的实验是______ _;
肯定不存在的阴离子有________ ___。
(2)经检测,该溶液中含有大量的 Cl- 、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积标准状况)的关系如下表所示,分析后回答下列问题:
Cl- 、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) |
2.8L |
5.6 L |
11.2 L |
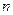 (Cl-) (Cl-) |
1.25mol |
1.5 mol |
2 mol |
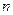 (Br-) (Br-) |
1.5 mol |
1.4 mol |
0.9 mol |
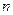 (I-) (I-) |
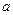 mol mol |
 0 0 |
0 |
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为___。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为_____________。
下表为元素周期表的一部分,请用化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________ ___(用元素符号表示)。
(2)请用化学方程式表示非金属性:②>⑦ _______ ____
(3)表中①、④两种元素的原子可按1:1组成一种具有二元弱酸性质的物质,请写出该物质
的电离方程式: 该弱酸性物质与⑤的最高价氧化物对应的水化物反应时可生成一种酸式盐,该酸式盐的电子式:
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以 下反应:
下反应:
A.X溶液与Y溶液反应的离子方程式为______________ _______,
B.N→⑥的单质的化学方程式为________________。
C.常温下,为了使0.1 mol/L M 溶液中由M电离出的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_____________ ____。
(5)由④、⑤、⑧三中元素形成的化合物溶液中,加入盐酸发生氧化还原反应的离子方程式是。