【化学—选修有机化学】
根据下列有机化合物,回答问题。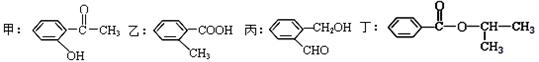
(1)上述互为同分异构体的化合物为 ;
(2)写出丙中官能团的名称 ;
(3)丁在一定条件下,可以发生水解反应,生成X、Y两种物质(相对分子质量:X<Y)。由X经下列反应可制得N、F两种高分子化合物,它们都是常用的塑料。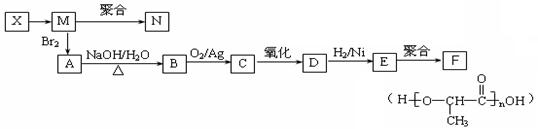
①X转化为M的反应类型是 。
②写出B转化为C的化学方程式 ;
③C与新制氢氧化铜反应的化学方程式为: 。
④在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式为 。
⑤写出3种含有一个羟基、一个酯基的E的同分异构体的结构简式:
、 、
下表是元素周期表的一部分,请参照①~⑥在表中的位置,用化学用语回答下列问题:
| I A |
ⅡA |
ⅢA |
ⅣA |
VA |
ⅥA |
ⅦA |
0 |
|
| 2 |
① |
② |
③ |
④ |
||||
| 3 |
⑤ |
⑥ |
(1) ⑥有两种同位素,其中一种原子核内有18个中子,其原子符号为_______;
(2)②与④可以形成一种温室气体,其电子式为_______;
(3) ③和⑤的氢化物沸点 __________(填分子式)高,原因是______________;
(4)②和⑥按原子个数比为1:4形成的化合物为_______分子(填极性或非极性),含有_______键(填极性或非极性)
(5) ②形成的单质可以是不同类型的晶体,它们可能是____________(填字母)
A原子晶体 B分子晶体 C金属晶体 D离子晶体 E.混合型晶体
800℃、2L密闭容器反应2NO(g)+O2(g) 2NO2(g)体系中, n(NO)随
2NO2(g)体系中, n(NO)随
时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
计算并回答下列问题:
(1)反应进行到2 s时c (NO)=。
(2)用O2表示从0~2s内该反应的平均速率υ=___________。 (3) 反应达到平衡状态时NO的转化率=。(提示 :)
(3) 反应达到平衡状态时NO的转化率=。(提示 :)
(4)判断一可逆反应是否达到平衡状态的依据有很多,某同学针对该反应提出一种设想:测定容器内气体的密度,当密度不再改变时即可判断出该反应已经达到平衡状态。你认为这种设想是否正确?(填“是”或“否”)请说明你的理由。
实验室配制一定物质的量浓度的溶液,需经计算、称量、溶解、移液、
洗涤、定容、摇匀、装瓶等步骤。现需配制0.2mol/L的CuSO4溶液500mL。
回答下列问题:
(1)用托盘天平称取CuSO4·5H2O晶体的质量是g。
(2)将溶解并冷却后的溶液转移的过程中用到的玻璃仪器有。
(3)定容时,加水至距刻度线1-2cm时改用胶头滴管滴加蒸馏水至。
(4)下列情况会使所配溶液浓度偏低的是。(填序号)
A定容时俯视
B未将洗涤烧杯后的溶液转移至容量瓶
C加蒸馏水时,不慎超过了刻度线
D砝码上沾有杂质(或者使用生锈的砝码)
E.容量瓶使用前未经干燥
乙烯是石油裂解气的主要成分,其产量通常用来衡量一个国家石油化工发展水平。回答下列问题:
(1)乙烯的结构简式为。
(2)下列能鉴别甲烷和乙烯的试剂是。(填序号)
| A.稀硫酸 | B.溴的四氯化碳溶液 |
| C.水 | D.酸性高锰酸钾溶液 |
(3)若以乙烯为主要原料合成乙酸,其合成线路如下图所示
① B物质官能团的名称。
② 反应Ⅱ的化学方程式为,反应类型是。
③ 工业上以乙烯为原料可以合成一种重要的有机高分子化合物,该反应的化学
方程式为。
有A、B、C、D、E五种原子序数小于18的元素,其特征信息如下:
| 元素编号 |
特征信息 |
| A |
其中一种原子核内只有质子没有中子 |
| B |
其原子的L层电子数是K层的3倍 |
| C |
其阳离子与B的阴离子具有相同的电子层结构, 且核电荷数与B相差3 |
| D |
其原子的最外层电子数等于电子层数,且是地壳 中含量较多的元素之一 |
| E |
单质为黄绿色气体,可用于制造漂白粉 |
请回答以下问题:
(1)由A、B、C三种元素形成的化合物含有的化学键类型是。
(2)由A、B、C元素中两两组合形成的化合物相互反应生成单质的化学方程
式。
(3)D单质与由A、B、C三种元素形成的化合物的水溶液反应的离子方程式
。
(4)写出实验室用软锰矿(MnO2)制取E的化学方程式。
(5)C和D两元素形成的单质活泼些较强的是(写元素符号),判断依据是。