(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4 (g)+H2O(g)=CO(g)+3H2(g) ΔH="+206.0" kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH="-129.0" kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置实现上述过程: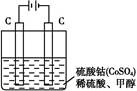
①写出阳极电极反应式: 。
②写出除去甲醇的离子方程式: 。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的负极反应式: 。
(4)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图: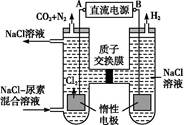
①电源的负极为 (填“A”或“B”)。
②阳极室中发生的反应依次为 。
③电解结束后,阴极室溶液的pH与电解前相比将 ;若两极共收集到气体13.44 L(标准状况),则除去的尿素为 g (忽略气体的溶解)。
水具有反常高的沸点,主要是因为分子间存在
某气体的摩尔质量为Mg/mol,分子数目为N,质量为mg,阿伏伽德罗常数为NA,试说明下列各式所表示的意义。
(1)N/NA:(2)M/NA:
(3)m/N:
V L Fe2(SO4)3溶液中,含有Fe3+ m g,则溶液中SO42-的物质的量浓度为__________________
一定的温度和压强下,1体积X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是_______________
有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、NaOH。将它们分别与稀H2SO4作用,A产生白色沉淀,B产生无色气体,C中无明显现象。
则A是________,B是________ , C是________。
写出反应的化学方程式:
_______________________________________________________