瑞典化学家舍勒在研究软锰矿(主要成分是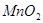 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: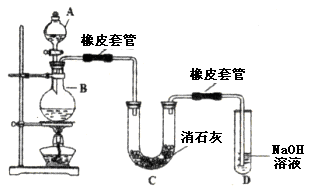
(1)A仪器的名称是__________,所盛试剂是__________,B中发生反应的化学方程式是__________。
(2)漂白粉将在U形管中产生,其化学方程式是____________________。
(3)此实验结果所得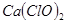 产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成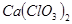 ,为避免此副反应的发生,可采取的措施是______________________________。
,为避免此副反应的发生,可采取的措施是______________________________。
②试判断另一个副反应(写出此反应方程式):____________________。为避免此副反应发生,应采取的措施是______________________________。
(4)漂粉精同盐酸作用产生氯气: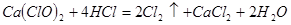 ,该反应中每生成
,该反应中每生成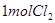 ,转移电子的物质的量为__________
,转移电子的物质的量为__________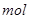 ,被氧化的
,被氧化的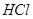 的物质的量为__________
的物质的量为__________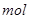 。有效氯是漂粉精中有效
。有效氯是漂粉精中有效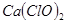 的含量大小的标志。已知:
的含量大小的标志。已知:
有效氯=(漂粉精加盐酸所释放出的氯气的质量/漂粉精的质量) 100%,该漂粉精的有效氯为65%,则该漂粉精中
100%,该漂粉精的有效氯为65%,则该漂粉精中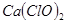 的质量分数为__________(保留一位小数)。
的质量分数为__________(保留一位小数)。
亚硝酸钠(NaNO2)又称工业盐,其外观类似食盐,但有剧毒。近年来,建筑工地多次发生民工误食工业盐而中毒的事件。利用如下反应可鉴别NaNO2和NaCl。
___KMnO4+___NaNO2+___H2SO4=___MnSO4+___K2SO4+___NaNO3+___H2O
(1)配平上述反应的化学方程式;
(2)指出该反应的氧化剂;
(3)当有2mol氧化剂被还原时,则转移的电子是mol。
在一密闭容器中,发生可逆反应
aA(g)+bB(g) cC(g)+dD(g)
cC(g)+dD(g) 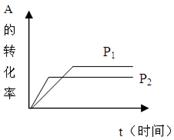
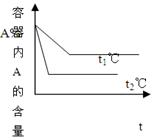
试据图回答:
(1)压强P1P2,a+bc+d(填<、>、=)
(2)温度t1℃比t2℃(填高或低),正方向为反应。(填放热或吸热)
在密闭容器中,通入xmolH2和ymolI2(g),存在H2+I2(g) 2HI(g)正反应为放热反应,改变下列条件,反应速率将如何改变(填增大、减小、或不变),平衡将如何改变(填向左、向右或不)
2HI(g)正反应为放热反应,改变下列条件,反应速率将如何改变(填增大、减小、或不变),平衡将如何改变(填向左、向右或不)
①升高温度,反应速率将,平衡将移动。
②加入催化剂,反应速率将,平衡将移动。
③充入更多的H2,反应速率将,平衡将移动。
④扩大容器的体积,反应速率将,平衡将移动。
⑤容器容积不变,通入氖气,反应速率将,平衡将移动。
(1)Mg(OH)2中混有的Al(OH)3的杂质可以用NaOH除去,请用离子方程式表示____________________
(2) Fe3+的检验用离子方程式表示___________________
(3) 在配制硫酸亚铁溶液时,常常加入铁粉,请说明原因____________(用离子方程式表示)
(4) 硫化钠水溶液显_____性(填酸、碱、中),原因_______________(用离子方程式表示)
(5) 写出镁条在二氧化碳中燃烧的化学方程式____________________
⑴事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是____________________________。
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.2H2(g)+O2(g)=2H2O(1)△H<0
C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0
⑵以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为_______________。
⑶电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与右图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:
①若a为CuSO4溶液,则电解时的化学反应方程式为____________________________________。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672 mL(标准状况下)时,溶液的pH = (假设电解后溶液体积不变)。