海水中提取镁的工业流程如下图所示:
回答下列问题。
⑴用贝壳而不从异地山中开凿石灰石的原因是______________________________。
⑵母液中含有MgCl2,写出反应池1的离子方程式_________________________。
⑶反应池1中,加入Ca(OH)2,使溶液的pH为11时,认为Mg2+沉淀完全[c(Mg2+)<1×10-5mol·L-1],则Mg(OH)2的溶度积约为_______________________。
⑷干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是_______________________________________________________________。
⑸电解槽中先得到的是镁的蒸气,镁蒸气可以在下列_____(填编号)气体氛围中冷却。
| A.空气 | B.氧气 | C.水蒸气 | D.氢气 |
⑹镁可用于生产金属钛,主要步骤有:①在高温下,向金红石(主要成分TiO2)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体;②在稀有气体(如氩)氛围和加热条件下,用镁与TiCl4反应可得到钛。写出上述两步反应的化学方程式。
反应①:____________________________________________________________;
反应②:____________________________________________________________。
某强酸性溶液X,含有
 中的一种或几种离子,取溶液进行连续实验,能实现如下转化:
中的一种或几种离子,取溶液进行连续实验,能实现如下转化:
依据以上信息,回答下列问题:
(1)上述离子中,溶液X中肯定含有的是: ____________________________不能肯定的是_____________________.对不能确定是否存在的离子,可以另取X溶液于一支试管中,选择下列试剂中的一种加入X溶液中 根据现象就可判般,则该试剂最好是:______________①NaOH溶液,②酚酞试剂,③石蕊试剂,④pH试纸⑤KSCN溶液,⑥KMnO4溶液。
根据现象就可判般,则该试剂最好是:______________①NaOH溶液,②酚酞试剂,③石蕊试剂,④pH试纸⑤KSCN溶液,⑥KMnO4溶液。
(2 )气体F的化学式为:______________,沉淀K的化学式为:_______,实验中,可以观察到反应②的现象是____________________________.
(3) 写出步骤①所有发生反应的离子方程式_____________________________ ;
(4) 要使步骤③中,D、H2O,O2三种物质恰好发生化合反应,则D、H2O, O2物质的量之比是____________________________。
现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2,等的排放,又可以扩大水煤气的广泛用途
(1) 已知: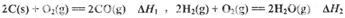
则反应 =_______,(用含
=_______,(用含 的代数式表示)
的代数式表示)
(2) CO和H2在一定条件下合成甲醇的反应为: ΔH3。向容积均为1L的a, b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2
ΔH3。向容积均为1L的a, b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2 的混合气体,控温,进行实验,测得相关数据如下图1和图2。
的混合气体,控温,进行实验,测得相关数据如下图1和图2。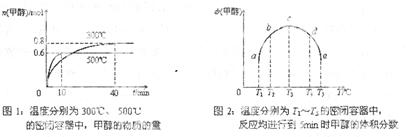
①该反应的 _______O (选填“<”、“>”或“=”)。
_______O (选填“<”、“>”或“=”)。
②对图2进行分析,从a到c段曲线变化特点看,温度升高甲醇体积分数增高的原因可能是:______________将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有_______
(3)某燃料电池以CO为燃料,以空气为氧化剂,以熔融态K2CO3为电解质。写出该燃料电池负极的电极反应式_______。
某研究性学习小组对氨气制法和性质进行如下设计:
⑴下面是该小组同学提出实验室制备氨气的几种方案
| A.硝酸铵固体和氢氧化钙固体混合加热 | B.加热氯化铵固体 |
| C.氯化铵固体和氢氧化钙固体混合加热 | D.将浓硫酸滴入浓氨水中 |
你认为可行的是(填字母,多选不给分),
该反应的化学方程式
⑵该小组同学把1 mol O2和NH3的混合气体导入密闭容器中,在催化剂的作用下加热,使之充分反应,恢复到常温常压下。若整个容器中的反应随着氧气的量的增加而发生如下两个反应:
4NH3 + 5O2  4NO + 6H20;4NO + 3O2 + 2H2O = 4HNO3设原混合气体中有x mol O2,最后容器中生成y mol HNO3,再向容器中注入一定量的H2O,得到溶液。
4NO + 6H20;4NO + 3O2 + 2H2O = 4HNO3设原混合气体中有x mol O2,最后容器中生成y mol HNO3,再向容器中注入一定量的H2O,得到溶液。
①向溶液中滴入酚酞,溶液呈红色,y = (用x的代数式表示,下同)
x的取值范围,
②容器中有不溶与水的气体,此气体在空气中变为红棕色,向溶液中滴入石蕊,溶液呈红色,y = ,x的取值范围
现有A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,已知A、D位于同一主族,A元素在元素周期表中原子半径最小,C是非金属性最强的元素,B、E原子最外层电子数相等,且B、E原子序数之和是A、D原子序数之和的两倍,F的最高价氧化物对应的水化物酸性最强。
(1)请在如图塔式元素周期表(元素周期表的另一种画法)相应位置中标出B元素的元素符号,同时在图中将过渡元素涂黑。
(2)D元素的简单离子的离子结构示意图
(3)B、E形成的气态氢化物的熔沸点那个高____________,(用具体的化学式表示)。
(4)E与C或F均能形成一些化合物,据有关资料E与C能形成化合物EC6,E能与F能形成化合物E2F2。请回答下面问题:
①甲同学通过分析认为EC6此物质不可能在O2中燃烧,原因是:,
②乙同学通过查资料知化合物E2F2中既存在极性键,又存在非极性键,试写出其电子式:;该物质遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液。试写出该过程的反应方程式:
写方程式
(1)H2O2+KMnO4+()=MnSO4+O2 +K2SO4+H2O
(2)请写出两个置换反应,要求:(a)非金属单质之间的置换,(b)在方程式中两种非金属单质必需是不同主族的。,