氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工原料。某研究小组用粗铜(含杂质Fe) 按下述流程制备氯化铜晶体(CuCl2·2H2O)。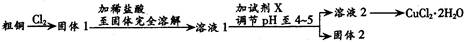
⑴实验室采用如右图所示的装置,可将粗铜与Cl2反应转化为固体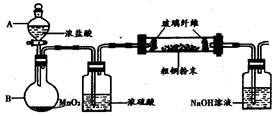
1(部分仪器和夹持装置已略去)。
①仪器A的名称是_________________。
②装置B中发生的反应的离子方程式是
__________________________________。
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要______(填“是”或“否”)。
⑵试剂X用于调节pH以除去杂质,X可选用下列试剂中的_________(填序号)。
a.NaOH b.NH3·H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
⑶在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色,小组同学欲探究其原因。已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl-(aq) CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K=________________________,若增大氯离子浓度,K值_________(填“增大”、 “减小”或“不变”)。
②取氯化铜晶体配制蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是___________(填序号)。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
为探究一溴环己烷与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、
乙两位同学分别设计如下两个实验方案:
甲:向反应混合物中滴入稀HNO3中和NaOH,后滴入AgNO3溶液,若有浅黄色沉淀,
则可以证明发生了消去反应。
乙:向反应混合物中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
⑴ 请评价上述两个方案是否合理,并说明理由。
甲:,。
乙:,。
⑵ 在上述两个方案中,能否对某个方案稍作改变即可达到实验目的,如需要改进,请指出进行改进的方案和改进方法。
。
写出下列方程式:(注明反应的条件,并配平方程式)
①实验室制乙炔
②乙烯与水反应
③乙烷与氯气生成一氯乙烷
④ 1,3 – 丁二烯与氯气发生1,4 – 加成
⑤甲苯与浓硝酸反应
分析下列有机化合物的结构简式,完成填空。
①CH3CH2CH2CH2CH3 ②C2H5OH ③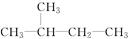
④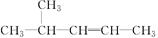 ⑤
⑤ ⑥
⑥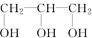 ⑦
⑦
⑧ ⑨
⑨ ⑩
⑩ ⑪
⑪
⑫CH3CHBrCH3 ⑬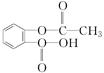 ⑭
⑭ ⑮
⑮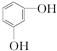
请你对以上有机化合物进行分类,其中:
(1)属于烷烃的是__①③__________;(2)属于烯烃的是____④_________ ;(3)属于芳香烃的是_____⑤⑧⑨_____;(4)属于卤代烃的是______⑫________;(5)属于醇的是____②⑥________;(6)属于醛的是________⑦⑪_______ ;(7) 属于羧酸的是___⑩⑬
_________;(8)属于酯的是____⑬⑭________;(9) 属于酚的是___⑮__________ 。
写出下列有机物的结构简式或名称:
⑴ 间甲基苯乙烯,⑵苯甲酸乙酯,
⑶ ,⑷
,⑷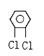 。
。
(5)命名下图所示有机物:__________________;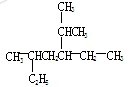
(6)若(5)中有机物是某单炔烃经过加成反应得到的,请写出此炔烃可能的结构简式__________________;
(11分) 已知有机物A不能发生银镜反应,也不能使溴水褪色;在一定条件下,A的苯环上发生卤代反应时只能产生两种一卤代物;A在一定条件下还能发生如下图所示的反应。B与过量的银氨溶液能发生银镜反应;C中具有八元环结构;D溶液中加入浓硝酸会变黄色;E能使溴水褪色。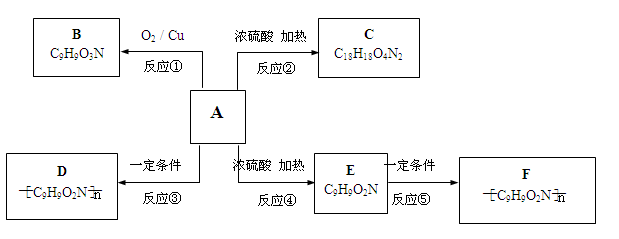
请回答:
(1)写出A的化学式:_______________;
AD的反应类型:;EF的反应类型:;
(2)写出下列变化的化学方程式: AC:;
EF:;
(3)写出D的结构简式: ____________ ;
(4)B发生银镜反应的离子方程式______________________;
(5)若E中的苯环和各官能团均保持不变,苯环上取代基的数目、位
置也不改变。写出符合上述条件的E的同分异构体有种。