水分子是H2O而不是H3O,是因为共价键具有 性;水分子的键角接近900是因为共价键具有 性。
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀。两极材料分别为铁和石墨。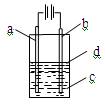
(1)a电极材料应为,电极反应式为。
(2)电解液c最好是(填编号)。
| A.纯水 | B.AgNO3溶液 | C.NaOH溶液 | D.CuCl2溶液 |
(3)d为苯,其作用是,在加入苯之前,
对c应作何简单处理?。
航天飞机常采用新型燃料电池作为电能来源,燃料电池可直接将化学能转化为电能。某电池以KOH溶液为电解质.其总反应的化学方程式为CH4+2O2+2OH- =CO32-+3H2O,根据题意回答下列问题:
(1)负极上的电极反应为_________________________________ 。
(2)消耗标准状况下5.6LO2时,有______mol电子发生转移。
(3)开始放电时,正极附近溶液的pH______(填“增大”“减小”或“不变”)
已知A、B、C是单质,其中A是金属,各物质间的转化关系如图: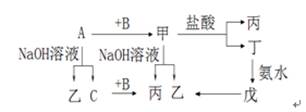
回答下列问题:(1)写出下列物质的化学式(各1分):
(1)A:________、B:________、乙:________、
丙:________、丁:________、戊:________
(2)写出A与NaOH溶液的化学方程式;
写出丁生成戊的离子方程式;
A、B、C、D四种化合物,其中A、C、D焰色反应均为黄色,而B的焰色反应为紫色(透过蓝色钴玻璃片),A、C和盐酸反应均得到D,将固体C加热可得到A,若在A的溶液中通入一种无色无味气体,又可制得C,若B的溶液滴加到硫酸亚铁溶液会先后出现白色沉淀→灰绿色沉淀→红褐色沉淀E。
试推断(各1分)
A:________、B:________、C:________、D:________、E:
写出A生成C的离子方程式:;
写出白色沉淀变为红褐色沉淀的化学方程式:;
以下是有关物质相互转化的关系图,其中A俗称铁红,常用做红色油漆和涂料,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色。
(1)若F是由Na+和SO42-组成的溶液,则A、甲、丙的化学式分别是、、(各1分)。
(2)若D是能使澄清石灰水变浑浊的气体,则乙的化学式为,丁属于(单质、酸、碱、盐)。(各1分)
(3)写出G  A+C的化学方程式:。
A+C的化学方程式:。