由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀。两极材料分别为铁和石墨。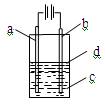
(1)a电极材料应为 ,电极反应式为 。
(2)电解液c最好是 (填编号)。
| A.纯水 | B.AgNO3溶液 | C.NaOH溶液 | D.CuCl2溶液 |
(3)d为苯,其作用是 ,在加入苯之前,
对c应作何简单处理? 。
.写出下列物质的电离方程式
(1)H2CO3
(2)KNO3
在100℃时,PH=7呈性。
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g)ΔH>0,已知该反应在2 404℃,平衡常数K=64×10-4。请回答:
2NO(g)ΔH>0,已知该反应在2 404℃,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为_____________________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志________。
| A.消耗1 mol N2同时生成1 mol O2 | B.混合气体密度不变 |
| C.混合气体平均相对分子质量不变 | D.2v正(N2)=v逆(NO) |
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,右图变化趋势正确的是____________(填字母序号)。
(4) 向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数________。(填“变大”、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此时反应_______________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是_____________________________。
(10分)对于A+2B(气)  nC(气)+Q在一定条件下达到平衡后,改变下列条件,请回答:
nC(气)+Q在一定条件下达到平衡后,改变下列条件,请回答:
(1)A量的增减,平衡不移动,则A为______态。
(2)增压,平衡不移动,当n=2时,A的状态为________;当n=3时,A的状态为______。
(3)若A为固体,增大压强,C的组分含量减少,则____。
(4)升温,平衡向右移动,则该反应的逆反应为________反应。
在100℃时,将0.200 mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间 |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4) |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
| c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的化学方程式为_________________________________,达到平衡时四氧化二氮的转化率为________%。
(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0~20s时间段内,四氧化二氮的平均反应速率为________mol•L-1•s-1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol•L-1。