合成氨反应(
 2NH3(g))在工业生产中的大量运用,满足了人口的急剧增长对粮食的需求,也为化工生产提供了足够的原料。按要求回答下列问题:
2NH3(g))在工业生产中的大量运用,满足了人口的急剧增长对粮食的需求,也为化工生产提供了足够的原料。按要求回答下列问题: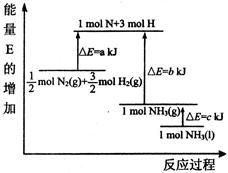
(1)合成氨反应的能量变化如图所示,则该反应的热化学方式为(△H用图给字母表示) 。
(2)在温度恒定为298K,体积恒定为10L的密闭容器中测得合成氨反应达到平衡时氢气、氮气、氨气的物质的量分别为0.1mol、0.4mol、4mol,则此温度下题给该反应的平衡常数K=
(3)标况下,若将22.4mL的氨气通入100mLpH为2的盐酸中,则溶液中各离子浓度的顺序由大到小为 。
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入足量的CO2,过滤后即可得到(NH4)2SO4。该过程的化学方程式为 ,由此可知Ksp(CaSO4) Ksp(CaCO3)(填“大于”、“小于”或“等于”)
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” )。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈,溶液中c(Na+) c(CH3COO-) (填“ >” 或“=”或“<” )。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈,醋酸体积氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)氢氧化钠溶液中c(OH-),m与n的大小关系是mn。
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2), 当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成 氮气和液态水时,放出的热量是________kJ。
氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快 速产生大量气体外,还有一个很突出的优点是________________________。
速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)="===2" NO2(g);△H="+67.7" kJ·mol-1, N2H4(g)+O2(g)="=="  N2(g)+2H2O (g);△H="-534" kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式_______________________________________。
N2(g)+2H2O (g);△H="-534" kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式_______________________________________。
(5)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_____________________________________________
2A B + C在某一温度时,达到平衡。
B + C在某一温度时,达到平衡。
(1)若温度升高,平衡向正反应方向移动,则正反应是___________反应(填“放热”或“吸热”);
(2)若B为固体,降低压强平衡向逆反应方向移动,则A呈___________态;
(3)若A是气态时,加压时,平衡不移动,则B为_________态,C为__________态;
(4) 若A、B、 C均为气体,加入催化剂,平衡___________移动(填“正向”、“逆向”或“不”)
C均为气体,加入催化剂,平衡___________移动(填“正向”、“逆向”或“不”)
(1 4分)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
4分)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
(1)用电离方程式解释NaHC2O4溶液显酸性的原因:;
(2)常温下,向10 m L 0.01 mol/L NaHC2O4溶液中滴加10mL 0.01 mol/L NaOH溶液时,比较溶液中各种离子浓度的大小关系,用>连接:;
L 0.01 mol/L NaHC2O4溶液中滴加10mL 0.01 mol/L NaOH溶液时,比较溶液中各种离子浓度的大小关系,用>连接:;
(3)配平以下氧化还原反应方程式:
(4)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL 溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中 。
。
①第一份溶液中加入2滴酚酞试液,滴加0.25 mol/L NaOH 溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+ 的物质的量为mol;
②第二份溶液滴加0.10 mol/L 酸性KMnO4溶液至16mL时反应完全,该溶液中还原剂的物质的量为_________mol。
③原试样中H2C2O4·2H2O的物质的量为_______ mol,KHC2O4的质量分数为________。
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g) CO2(g)十H2 (g),△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率υ(CO)=mol/(L·min),此时该反应的平衡常数为。
CO2(g)十H2 (g),△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率υ(CO)=mol/(L·min),此时该反应的平衡常数为。
(2)T ℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min~4min之间反应处于 状态;c10.08 (填 “>”、“<”或“=”)。
状态;c10.08 (填 “>”、“<”或“=”)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是(填序号,下同),表中5min~6min之间数值发生变化,可能的原因是。
a.增加了水蒸气的量 b.降低温度
c.使用催化剂 d.增加氢气的浓度