【化学—化学与技术】硫酸是一种重要的化工原料,硫酸工业的“三废”处理之一是对尾气处理,其中一种方法便是用天然海水进行尾气脱硫。
(1)硫酸工业生产的主要设备有 、 和吸收塔。在吸收塔内装有大量磁环的作用是 ,浓硫酸从塔顶喷下,SO3吸收操作采取 形式(原理);硫酸工业的尾气主要成分有SO2、O2、N2等。
(2)天然海水主要含有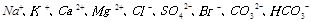 等离子。
等离子。
①天然海水pH约为8,原因是海水中 离子水解所致。
②尾气进入吸收塔内,塔顶喷下大量海水,O2能将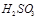 、
、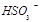 、
、 等氧化,试写出其中一个反应的方程式: 。
等氧化,试写出其中一个反应的方程式: 。
③向氧化后的海水中加入天然海水,其目的是中和、稀释氧化后海水中生成的酸,最终排放出的海水中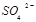 浓度与进入吸收塔的天然海水相比,
浓度与进入吸收塔的天然海水相比,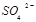 浓度 (填序号)。
浓度 (填序号)。
| A.减少 | B.增大 | C.不变 | D.无法判断 |
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Ag+、Na+ |
| 阴离子 |
NO3—、SO42—、Cl- |
下图Ⅰ所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了27 g。常温下各烧杯中溶液的pH与电解时间t的关系如下图Ⅱ所示。据此回答下列问题:
(1)M为电源的________(填“正”或“负”)极,A是________(填写化学式)。
(2)计算电极f上生成的气体在标准状况下的体积:________。
(3)写出乙烧杯的电解池反应:________________________________________________。
(4)要使丙恢复到原来的状态,应加入________ g ________(填写化学式)。
在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
| 阳离子 |
K+、Ag+、Mg2+、Ba2+ |
| 阴离子 |
NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀HCl |
产生白色沉淀并放出0.56L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4g |
| Ⅲ |
在Ⅱ的滤液中滴加BaC12溶液 |
无明显现象 |
试回答下列问题:
(1)实验I能确定一定不存在的阳离子是。
(2)实验I中生成沉淀的离子方程式为。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 阴离子 |
NO3- |
CO32- |
SiO32- |
SO42- |
| c/mol·L-1 |
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由。
(每个方程式2分,其余每空1分,共8分)现有下列物质:
①KI②铜③稀硝酸 ④NH3⑤NaHSO4⑥Ba(OH)2⑦氢氧化铁胶体 ⑧氨水
(1)按物质的分类方法填写表格的空白处(填物质编号)
| 分类标准 |
电解质 |
盐 |
非电解质 |
混合物 |
| 属于该类的物质 |
(2)上述某两种物质在溶液中可发生离子反应:H++OH-=H2O,写出该离子反应对应的化学方程式。
(3)物质①的稀溶液在空气中被氧化,加入淀粉溶液显蓝色,则反应的离子方程式为。
某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O。已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。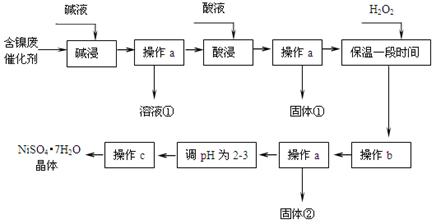
部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| pH |
5.2 |
3.2 |
9.7 |
9.2 |
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、蒸发皿外还需要的主要仪器为。
(2)“碱浸”过程中发生的离子方程式是。
(3)“酸浸”时所加入的酸是(填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是:。
(5)“调pH为2~3”的目的是。
(6)产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是 __。
有一瓶澄清溶液,其中可能含有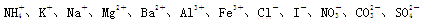
中的几种。取该溶液进行以下实验:
(1)用pH试纸检验,表明溶液呈强酸性。排除存在。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡,CCl4层呈紫红色。排除______存在。
(3)另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生。则可排除存在。取部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
(4)另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成。
证明存在,又排除存在。
(5)根据上述实验事实确定:
①该溶液中肯定存在的离子是;
②肯定不存在的离子是;
③还不能确定是否存在的离子是。