海水占地球总储水量的97%以上。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)目前国际上使用的“海水淡化”主要技术有_______________________________________。
(2)工业上利用电解饱和食盐水可制得重要化工产品,用离子交换膜电解槽电解饱和食盐水,反应的离子方程式是__________________________________________________________,
阳离子交换膜的作用是________________________________________________________。
若不使用离子交换膜法电解食盐水,可得到一种消毒液,其反应的化学方程式是
________________________________________________________________________。
(3)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,写出此过程中SO2被吸收以及又生成可被回收的气体的两个反应的化学方程式________________________________________________________________________。
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)焙烧硫铁矿的主要方程式为。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为(写化学式) 。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在:
(5) 如果将氯化铁晶体(FeCl3·6H2O)放在坩埚中加热灼烧,最后得到的固体为 。
(6)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
①V2O5作催化剂②通入过量O2③SO2、O2进行二次氧化④通入过量SO2
(I)下图是工业生产硝酸铵的流程。
(1)吸收塔C中通入空气的目的是 。A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:①4NH3(g) + 3O2(g) = 2N2(g) +6H2O(g)△H =-1266.8kJ/mol
②N2(g) + O2(g) = 2NO(g)△H =" +180.5" kJ/mol
写出氨高温催化氧化的热化学方程式:
(II)某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。
(3)该反应的离子方程式为___________________________________________________。
(4)提出合理假设。该实验中反应速率明显加快的原因可能是_____________________。
A.反应放热导致温度升高 B.压强增大
C.生成物有催化作用 D.反应物接触面积增大
(5)初步探究。测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
35 |
50 |
60 |
70 |
80 |
| 温度/℃ |
25 |
26 |
26 |
26 |
26 |
26 |
26.5 |
27 |
27 |
27 |
27 |
结合实验目的和表中数据,你得出的结论是__________________________________。
(6)进一步探究。查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用,请完成以下实验设计表并将实验目的补充完整:
| 实验 编号 |
铜片 质量/g |
0.1mol·L-1的 硝酸体积/mL |
硝酸铜 晶体/g |
亚硝酸钠 晶体/g |
实验目的 |
| ① |
5 |
20 |
_______ |
_______ |
实验①和②探究_________的影响;实验①和③探究亚硝酸根的影响。 |
| ② |
5 |
20 |
0.5 |
0 |
|
| ③ |
5 |
20 |
0 |
0.5 |
液晶高分子材料应用广泛。新型液晶基元------化合物Ⅳ的合成线路如下:
(1)化合物Ⅰ的分子式为__________ ,1mol化合物Ⅰ完全燃烧消耗_____molO2。
(2)CH2=CH-CH2Br与NaOH水溶液反应的化学方程式为_____(注明条件)。
(3)写出符合下列条件的化合物Ⅰ的同分异构体的结构简式。
I. 苯环上有3个取代基 II.苯环上一溴代物只有2种III.能发生银镜反应
(4)下列关于化合物Ⅱ的说法正确的是_______(填字母)。
| A.属于烯烃 | B.能与FeCl3溶液反应呈紫色 |
| C.一定条件下能发生加聚反应 | D.最多能与4molH2发生加成反应 |
(5)反应③的反应类型是____________。在一定条件下,化合物 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是______________。
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是______________。
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ,ΔH=—76.0 kJ·mol-1,该反应中每放出38 kJ热量,转移电子的物质的量为mol.
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0
CH4(g)+2H2O(g) ΔH<0
①向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO20.2mol·L—1,H20.8mol·L—1, CH40.8mol·L—1,H2O1.6mol·L—1,起始充CO2和H2的物质的量分别为、。CO2的平衡转化率为
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器I、II,在I中充人1 mot CO2,和4 molH2,在II中充人1 mol CH4和2 mol H2 O(g) , 300℃下开始反应。达到平衡时,下列说法正确的是(填字母)。
| A.容器I、II中正反应速率相同 |
| B.容器I、II中CH4的物质的量分数相同 |
| C.容器I中CO2的物质的量比容器II中的多 |
| D.容器I中CO2的转化率与容器II中CH4的转化率之和小于1 |
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示: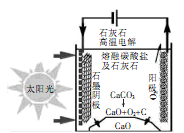
①上述生产过程的能量转化方式是
②上述电解反应在温度小于900 0C时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为,阴极的电极反应式为
溴化钙(CaBr2·2H2O)是一种白色晶体,易溶于水,有很强的吸湿性,是光敏纸矿泉水和灭火剂的重要成分,在医药上用作治疗神经衰弱等的药物,也用作化学分析。用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下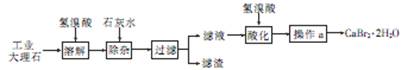
回答下列问题
(1)溶解时发生的主要反应的离子方程式为
(2)除杂步骤控制溶液的pH约为8.0的目的是,
(3)滤液用氢溴酸酸化的目的是,操作a主要包括,和过滤
(4)制得的溴化钙晶体可以通过如下步骤测定其纯度:
①称取5.00g溴化钙晶体样品,②溶解;③滴入足量Naa2CO3溶液,充分反应后过滤,④烘干、冷却;⑤称量。若得到2. 00 g碳酸钙,则样品的纯度为
(5)溴化钙晶体中溴离子和钙离子的检验
①将少量溴化钙晶体溶于水,加入硝酸酸化的AgNO3溶液,实验现象为,发生反应的离子方程式为
②将少量溴化钙晶体溶于水,滴加草酸钠溶液,实验现象为,发生反应的离子方程式为