KNO3、NaCl溶液在生产、生活中起着十分重要的作用。下表是它们在不同温度时的溶解度,右图是它们的溶解度曲线。
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
| NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.8 |
(1)以上两种物质溶解度的变化受温度影响较小的是_____。
(2)30℃时,KNO3的溶解度是________g。
(3)右图中A点的含义是______________。

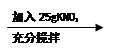 (4)某同学做了如下两个实验。
(4)某同学做了如下两个实验。
实验1:20℃时,100g水 a b c
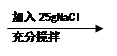
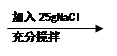
实验2:20℃时,100g水 d e f
判断a~f对应的溶液中,为饱和溶液的是 ;
由实验1、2可知,使不饱和溶液转化为饱和溶液的方法有 。
(5)右图所示,小烧杯中盛放的是实验1中的KNO3溶液b。若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是 (填字母)。
A.冰 B.氧化钙 C.硝酸铵
D.干冰 E固体氢氧化钠 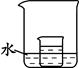
(1)为了让不爱吃蔬菜的学生营养均衡,家长把榨好的各种颜 色的蔬菜汁放在面粉里和面,做成口味独特、营养丰富的蔬菜馒头。这种馒头为人体提供的营养素是
.
(2)其中面粉所含营养素能为机体活动和维持恒定体温。
(3)小麦在生长过程中需施钾肥,其作用是能促进植物生长,增强能力。
(4)若还需补充氮元素,则能同时提供这两种营养元素的复合肥是(填化学式)。

(1)金属
加入稀硫酸中,有气泡产生;铝片插入
的硫酸盐溶液中,有金属
析出。则
的金属活动性由强到弱的顺序是。
(2)为了减少汽车尾气的污染,使用环保型汽车是未来的发展趋势。如以天然气为燃料的汽车、氢能源汽车和电动汽车等。天然气的主要成分是。
(3) 氢能源具有的优点是(填一条)。
请根据下列装置回答问题: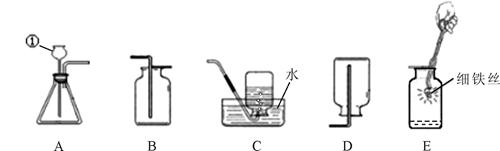
(1)写出仪器①的名称。
(2)实验室制取
和
都可以利用
装置,收集
和
都可以利用装置(填字母序号)。
(3)收集一瓶氧气,供
实验使用。
中发生化学反应的基本类型是,
中集气瓶底部少量水的作用是。
按要求填空:
(1)空气中常见的污染物有(填一种);
(2)农业生产中的一种复合肥料;
(3)能使湿润的红色石蕊试纸变蓝色的气体(填化学式);
(4)构成氧化钙的阴离子符号;
(5)电解水实验中,与电源负极相连的支管内收集的气体是。
生活中常用的不粘锅,其内衬用的一种材料叫聚四氟乙烯。该材料属于()
| A. | 金属材料 | B. | 纳米材料 | C. | 复合材料 | D. | 有机合成材料 |