下表是五种银盐的溶度积常数(25℃)。下列说法错误的是
| 化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
| 溶度积 |
1.8×10-10 |
1.4×10-5 |
6.3×10-50 |
7.7×10-13 |
8.5×10-16 |
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将AgCl溶解于水后,向其中加入Na2S则可以生成黑 色沉淀
色沉淀
C.AgCl 、AgBr、AgI三种物质在常 温下的溶解度按氯、溴、碘的顺序减小
温下的溶解度按氯、溴、碘的顺序减小
D.向100ml0.1mol/LNa2SO4溶液中加入1mL0.1mol/L AgNO3溶液,有沉淀生成
下列陈述I、II均正确并且有因果关系的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
NaHCO3溶于水完全电离 |
NaHCO3强电解质 |
| B |
SiO2是两性氧化物 |
SiO2可和HF反应 |
| C |
Fe3+有氧化性 |
铁盐可用作净水剂 |
| D |
SO2有漂白性 |
SO2可使含酚酞NaOH溶液褪色 |
下列关于有机化合物的认识不正确的是
| A.油脂在空气中完全燃烧转化为水和二氧化碳 |
| B.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 |
| C.乙烯通入高锰酸钾溶液中,溶液褪色是因为发生了加成反应 |
| D.在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应 |
常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(SO32-):n(HSO3-)变化的关系如下表:
| n(SO32-):n(HSO3-) |
91:1 |
1:1 |
9:91 |
| pH |
8.2 |
7.2 |
6.2 |
以下离子浓度关系的判断正确的是
A.NaHSO3溶液中c(H+)<c(OH-)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)=c(H+)
D.当吸收液呈中性时,c(Na+)= c(HSO3-)+2 c(SO32-)
用气体传感器可以检测汽车尾气中CO的含量。传感器是以燃料电池为工作原理,其装置如右图所示,该电池中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是
A.负极的电极反应式为:CO+O2-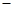 2e-=CO2 2e-=CO2 |
| B.工作时电子由电极a通过传感器流向电极b |
| C.工作时电极b作正极,O2-由电极a流向电极b |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
下列叙述正确的是
| A.加入铝粉能产生H2的溶液中可能大量共存的离子组:NH4+、Fe2+、SO42-、NO3- |
| B.常温下由水电离出的H+与OH-的浓度积为10-20mol2·L-2的溶液中可能大量共存的离子组:Na+、S2-、Cl-、CO32- |
| C.向FeI2溶液中通入过量Cl2的离子方程式:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| D.向Ca(ClO)2溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O=2HClO+CO32- |