工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2+O2 2SO3,这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中,错误的是
2SO3,这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中,错误的是
A.使用催化剂是为了加快反应速率,提高生产效率 |
B.在上述条件下,SO2不可能100%地转化为SO3 |
C.达到平衡时,改变反应条件可以在一定程度上改变该反应的化学平衡状态 |
D.达到平衡时,SO2的浓度与SO3的浓度相等 |
以乙炔作为原料的合成反应,下列过程中能生成CH2BrCHBrCl的是
| A.先加HCl,再加HBr | B.先加Cl2再加HBr |
| C.先加HCl,再加Br2 | D.先加HBr,再加HCl |
下列物质的沸点按由高到低的顺序排列正确的是
①CH3(CH2)2CH3②CH3(CH2)3CH3③(CH3)3CH④(CH3)2CHCH2CH3
| A.②④①③ | B.④②①③ | C.④③②① | D.②④③① |
某炔烃氢化后得到的饱和烃如下: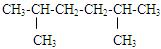 ,该烃可能的结构有
,该烃可能的结构有
| A.1种 | B.2种 | C.3种 | D.4种 |
从烷烃(CnH2n+2),烯烃(CnH2n),二烯烃(CnH 2n-2)的通式分析,得出碳氢原子的个数与分子中所含双键有一定关系,某种烃的分子式为CxHy,其中所含双键数目为
2n-2)的通式分析,得出碳氢原子的个数与分子中所含双键有一定关系,某种烃的分子式为CxHy,其中所含双键数目为
A. |
B. |
C.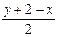 |
D. |
将苯分子中的一个碳原子换成一个氮原子,得到一种类似苯的结构的稳定有机物,此有机物的相对分子质量为
| A.78 | B.79 | C.80 | D.81 |