根据下表信息,下列叙述中正确的是
| 序号 |
氧化剂 |
还原剂 |
其他反应物 |
氧化产物 |
还原产物 |
| ① |
C12 |
FeBr2 |
|
|
Cl- |
| ② |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
Mn2+ |
| ③ |
KClO3 |
浓盐酸 |
|
Cl2 |
C12 |
| ④ |
KMnO4 |
浓盐酸 |
|
Cl2 |
Mn2+ |
A、表中①组反应的氧化产物一定只有FeCl3
B、氧化性强弱比较:KMnO4>C12>Fe3+>Fe2+
C、还原性强弱比较:H2O2>Mn2+>Cl-
D、③反应中的浓盐酸即起还原剂作用又起酸的作用
关于如图所示装置的叙述,正确的是()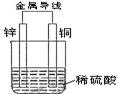
| A.铜是负极,铜片上有气泡产生 | B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 | D.氢离子在铜片表面被还原 |
含n g硝酸的稀溶液恰好和m g铁粉完全反应若有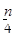 g HNO3被还原成NO,n:m可能
g HNO3被还原成NO,n:m可能
| A.1:1 | B.2:1 | C.3:1 | D.9:2 |
下列物质中,不属于电解质的是:
| A.乙醇 | B.CH3COOH | C.BaCl2 | D.Cl2 |
下列反应的离子方程式正确的是()
| A.氯气通入氢氧化钠溶液中 Cl2 +2OH― = Cl― + ClO― + H2O |
| B.金属铁与稀硝酸反应 Fe + 2H+ = Fe2+ + H2↑ |
| C.在硅酸钠溶液中滴加稀硫酸 SiO32― + 2H+ = H2SO3↓ |
| D.铜粉与98.3%的硫酸加热下反应 Cu + 4H+ + SO42― = Cu2+ + SO2↑ + 2H2O |
设阿伏加德罗常数为NA,则下列说法正确的是()
| A.1.5g甲基(—CH3)所含有的电子数是NA |
| B.14g乙烯和丙烯的混合物中含有原子的数目为NA |
| C.标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为5/22.4 NA |
| D.常温常压下,1mol CnH2n+2中所含有的共价键数目为(3n+1)NA |