(14分)用图示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75OC)。已知:PCl3和PCl5遇水强烈反应,它们熔沸点数据如下:
请根据图中装置回答下列问题:
(1)检查该 装置气密性的方法是
装置气密性的方法是
(2)为得到氯气,若B中加入MnO2,则A中应加入 ,发生反应的化学方程式为 。
(3)若发现C中气泡产生过猛,需要进行的操作的关键是 。
(4)在反应开始时主要生成PCl3,而后来主要生成PCl5,原因可能是 ;
从PCl3和PCl5的混合物中分离出PCl3的最佳方法是 (选填序号)。
a、蒸馏 b、分液 c、升华
(5)生成的PCl3在G中收集,则F中 盛有 , 作用是
盛有 , 作用是
(6)C、D、H所盛的试剂分别是:C ;D ;H 。
(7)如果E中反应放热较多,G处的导管可能发生堵塞,其原因是 。
请回答有关下列五种气体:H2、O2、NO、NH3、NO2的问 题。
I.(1)与制取O2的发生装置相同的是;______________只能用一种方法收集的是______________________________
(2)以上气体制备反应中,有一反应在原理上与其它反应都不能归为同一类型,请写出实验室制取该气体的方程式_________________________________
II. 用右图装置进行喷泉实验(图中夹持装置均已略去)。
(1)若用图1装置进行喷泉实验,上部烧瓶已装满干燥的氨气,引发水上喷的操作是_____________________该实验的原理是______________________________________
(2)若用图2的装置,请举一例说明引发喷泉的方法___________________________
III:若用同一烧瓶分别充满如下气体:① HCl② NH3③ NO2进行喷泉实验,实验后烧瓶内溶液液面的高度关系为____________________________ (用序号和“>,<或=”表示,下同),所得溶液物质的量浓度大小关系为 ____________________________ 。
(5分)实验室用氢氧化钠固体配制l00 mL 2 mol·L-1的NaOH溶液,回答下列问题:
(1)配制操作中,用不到的仪器是(填字母)。
A.烧杯 B.200 mL容量瓶 C.量筒 D.胶头滴管
E.玻璃棒 F.100 mL容量瓶
(2)下列操作的顺序是(每项限选一次)。
A.称量 B.溶解 C.洗涤 D.定容 E.转移 F.摇匀 G.冷却
(3)(以下小题填“偏大”、“偏小”或“无影响”)
若容量瓶中有少量蒸馏水,所配溶液的浓度将;
若用2 mol·L-1的NaOH溶液先润洗容量瓶,再转移溶液,所配溶液的浓度将。
(4分)实验室利用右图所示装置进行Na2CO3和NaHCO3热稳定性对比实验。请回答:
(1)加热一段时间后,两试管中石灰水的变化是。
A.均变浑浊
B.试管1澄清,试管2变浑浊
C.试管2澄清,试管1变浑浊
(2)该实验说明二者中热稳定性强的物质是(填化学式),另一种物质受热分解的化学方程式是。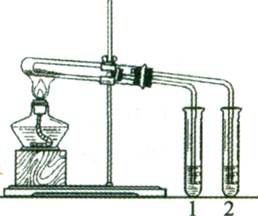
(10分)利用催化剂可使NO和CO发生反应:2NO(g)+2C0(g) 2CO2(g)+N2(g) △H<0。
2CO2(g)+N2(g) △H<0。
已知增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
(1)请填全表中的各空格;
(2)实验I中,NO的物质的量浓度(c)随时问(t)的变化如下图所示。请在给出的坐标图中画出实验Ⅱ、III中NO的物质的量浓度(c)随时间(t)变化的曲线,并标明各曲线的实验编号。
下图装置Ⅰ是实验室制乙酸乙酯的常用装置: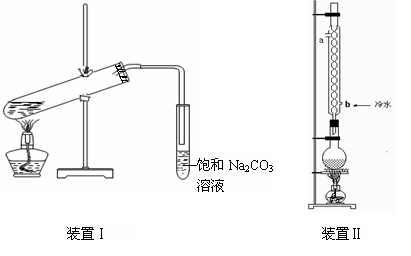
实验中所用的某些试剂及产物的相关数据如下:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
||
| 乙醇 |
-114 |
78 |
0.789 |
||
| 乙酸 |
16.6 |
117.9 |
1.05 |
||
| 乙酸乙酯 |
-83.6 |
77.5 |
0.900 |
||
| 98%H2SO4 |
10 |
338 |
1.84 |
回答下列问题:
(1)如果用CH3CO18OH与CH3CH2OH反应,写出该反应的化学方程式 ,浓H2SO4的作用是 。
(2)要从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入 (填仪器名称),用力振荡,静置, (填现象),然后将产物从_____口(填“上”或“下”)倒出。
(3)采用装置Ⅱ可提高乙酸乙酯的产率,结合表格中的数据,说明该装置可提高乙酸乙酯产率的原因: 。