830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)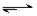 CO2(g)+H2(g) △H<0试回答下列问题:
CO2(g)+H2(g) △H<0试回答下列问题:
(1)若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= 。
(2)在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是 。
(3)若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
按要求完成下列填空:
(1)下列有机物中有结构简式却没有名称的请用系统法命名:
①甲烷②CH3-C(CH3)=CH-CH=CH2名称: ③乙炔④甲苯⑤CH2(OH)-CH-CH2-CH3
③乙炔④甲苯⑤CH2(OH)-CH-CH2-CH3
CH2OH名称:
(2)第(1)小题所列物质中:(以下各小题填序号回答)
Ⅰ.分子中中心原子采取sp杂化的是;
Ⅱ.核磁共振氢谱只有一个吸收峰的是;
Ⅲ.分子与分子之间存在氢键的是;
Ⅳ.能与溴水反应并使其褪色的是;
(每空2分)反应A()+B()  C() +D()过程中的能量变化如图所示,回答下列问题。
C() +D()过程中的能量变化如图所示,回答下列问题。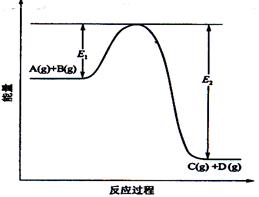
(1)该反应是____________________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”“减小”“不变”),
原因是____________________________________________;
(3)反应体系中加入催化剂对反应热是否有影响?_______________,原因是_________:
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小、”“不变”)。
废旧印刷电路板的回收利用可实现资再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是(填字母)。
| A.热裂解形成燃油 | B.露天焚烧 |
| C.作为有机复合建筑材料的原料 | D.直接填埋 |
(2)用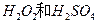 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知: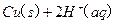 ====
====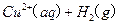
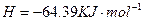
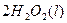 ====
====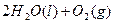
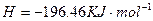
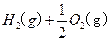 ="==="
="===" 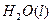
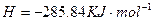
在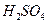 溶液中
溶液中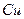 与
与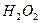 反应生成
反应生成 和
和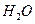 的热化方程式为。
的热化方程式为。
(3)控制其他条件相同,印刷电路板的金属粉末用10℅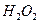 和3.0
和3.0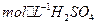 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| 铜平均溶解速率 ( 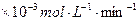 )[:.....] )[:.....] |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是。
(4)在提纯后的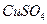 溶液中加入一定量的
溶液中加入一定量的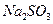 和
和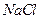 溶液,加热,生成
溶液,加热,生成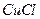 沉淀。制备
沉淀。制备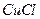 的离子方程式是。
的离子方程式是。
(每小题3分,共9分)恒温恒压下,在一个容积可变的密闭容器中发生如下反应:
(1)若开始时通入 ,达平衡时生成
,达平衡时生成 的转化率为。
的转化率为。
(2)若开始时通入 ,达平衡时SO2的物质的量为mol。
,达平衡时SO2的物质的量为mol。
(3)若在(2)的平衡混合物中再通入bmol SO3,则达到平衡时SO3的体积分数是。
(每空3分,共9分)在一定条件下,反应 达到平衡。
达到平衡。
(1)若A、B、C都是气体,在增压后平衡向逆反应方向移动,则,y,之间的关系是。
(2)若C是气体,且+y=,在增大压强时,如果平衡发生移动,则A的转化率将(填“增大”、“减小”或“不变”)
(3)若A为固体,B、C为气体,且y>,则增大压强时混和气体的平均相对分子质量将(填“增大”“减小”或“不变”)