苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应原理,可以进行苯甲酸甲酯的合成。有关物质的物理性质、实验装置如下所示:
| |
苯甲酸 |
甲醇 |
苯甲酸甲酯 |
| 熔点/℃ |
122.4 |
-97 |
-12.3 |
| 沸点/℃ |
249 |
64.3 |
199.6 |
| 密度/g.cm-3 |
1.2659 |
0.792 |
1.0888 |
| 水溶性 |
微溶 |
互溶 |
不溶 |
实验一:制取苯甲酸甲酯
在大试管中加入15g苯甲酸和一定量的甲醇,边振荡边缓慢加入一定量浓硫酸,按图A连接仪器并实验。
(1)苯甲酸与甲醇反应的化学方程式为_______________ _________。
(2)大试管Ⅰ中除了装有15g苯甲酸和一定量的甲醇和一定量浓硫酸外还需要加入
。
(3)中学实验室中制取乙酸乙酯时为了提高酯的产率可以采取的措施有
__________________ ________ 。
实验二:提纯苯甲酸甲酯
该实验要先利用图B装置把图A中制备的苯甲酸甲酯水洗提纯,再利用图C装置进行蒸馏提纯
(4)用图B装置进行水洗提纯时,B装置中固体Na2CO3作用是 。
(5)用图C装置进行蒸馏提纯时,当温度计显示______时,可用锥形瓶收集苯甲酸甲酯。
实验三:探究浓硫酸在合成苯甲酸甲酯中的作用
(6)比较有、无浓硫酸存在条件下酯化反应进行的快慢,在其他实验条件相同时需要测量的实验数据是 。
下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
(1)制备氯气选用的药品为二氧化锰和浓盐酸,则相关的化学反应方程式为: 。
(2)装置B中饱和食盐水的作用是 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入 。
| a |
b |
c |
d |
|
| Ⅰ |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| Ⅱ |
碱石灰 |
无水CaCl2 |
浓硫酸 |
无水CaCl2 |
| Ⅲ |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为 色,打开D装置中活塞,将D中少量溶液加入装置E中,振荡。观察到的现象是 。经认真考虑,有同学提出该实验方案仍有不足,请说明其中不足的原因是 。
(5)装置F中用足量NaOH溶液吸收剩余的氯气,试写出相应的化学方程式: 。
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO 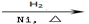 CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
CO的制备原理:HCOOH  CO↑+H2O,并设计出原料气的制备装置如下:
CO↑+H2O,并设计出原料气的制备装置如下: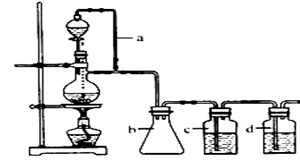
请填写下列空白:
(1)实验室现有稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备丙烯。写出化学方程式: 。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是 、 ;
c和d中盛装的试剂分别是 , 。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是 _(填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)正丁醛经催化剂加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:
试剂1为_________,操作1、操作2为、操作3分别为_____________________。
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
(1)A的相对分子质量为:________。 |
| (2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g。 |
(2)A的分子式为:________。 |
| (3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。 |
(3)用结构简式表示A中含有的官能团:________、________。 |
| (4)A的核磁共振氢谱如下图: |
|
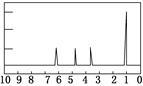 |
(4)A中含有________种氢原子。 |
| (5)综上所述,A的结构简式________。 |
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
请回答下列问题:
(1)滴定时,将酸性KMnO4标准液装在如图中的__________(填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志是_______________________。
(3)通过上述数据,求得x=________。讨论:
①若滴定终点时俯视滴定管,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
实验室用如图的仪器药品制取氯化铁粉末,已知信息:氯化铁粉末易吸水生成结晶水化合物FeCl3+6H2O=FeCl3•6H2O。
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序)
接 , 接 , 接 , 接 ;
烧瓶A中反应的离子方程式是 ;
(2)仪器C名称 ,安装它的实验目的是 ,容器E作用是 ;
(3)A、B中的酒精灯应先点燃 处(填“A”或“B”)酒精灯,反应一段时间,再点燃另一个。理由是 ;
(4)这套实验装置是否完整? (填“是”或“否”),若不完整还须补充 装置(若第一问填“是”,则此问不需作答).