氢化阿托醛是一种重要的化工原料,其合成路线如下:
(1)氢化阿托醛被氧化后的含氧官能团的名称是 。
(2)在合成路线上②③的反应类型分别为② ③ 。
(3)反应④发生的条件是 。
(4)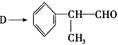 反应的化学方程式为 。
反应的化学方程式为 。
(5)1mol氢化阿托醛最多可和 mol氢气加成,1mol氢化阿托醛发生银镜反应可生成 molAg。
(6)D有多种同分异构体,能满足苯环上有两个取代基,且能使FeCl3溶液显紫色的同分异构体有 种。
下表是元素周期表的一部分,回答下列有关问题(用化学符号回答):
 族 族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
||
| 4 |
⑩ |
(1)在①~⑩元素中,最活泼的金属元素是,最活泼的非金属元素是,最不活泼的元素是。
(2)在①~⑩元素的最高价氧化物对应的水化物中,酸性最强的是,碱性最强的是,呈两性的是。写出在水溶液中三者之间相互反应的离子方程式:,,
。
(6分)现有①H2O2②HClO③NH4Cl④Na2O2⑤干冰五种物质,按下列要求回答:(填序号)
(1)既存在离子键又存在共价键的是。
(2)写出①的电子式是_____ ___,②的电子式是_____ ___,
③的电子式是_____ ___,④的电子式是_____ ___,
⑤的电子式是___ _ ____,
(4分)将下列物质进行分类(填序号)
① O2与O3②126C与136C③金刚石与石墨④冰与水⑤ H2、D2、T2
⑥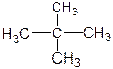 和
和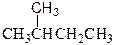
(1)互为同位素的是(2)互为同素异形体的是
(3)互为同分异构体的是(4)属于同一化合物的是
已知:一个碳原子上连有两个羟基时,易发生下列转化:



请根据下图作答(图中无机产物均省去):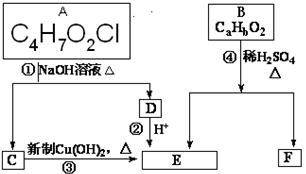
C中含有的官能团的名称是________________。
③反应类型为。
D的结构简式为_________________________。
(2) 写出反应①化学方程式
(3)已知B的相对分子质量为162,其完全燃烧的产物中n(CO2):n(H2O)=2:1,则B的化学式为_______________________________。
(4)若F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应:③苯环上的一氯代物只有两种。则F在一定条件下发生加聚反应的化学方程式为_____________。
(5)化合物G是F的同分异构体,属于芳香族化合物,能发生银镜反应。G有种结构,写出其中一种的结构简式______________________。
饱和盐溶液W的电解产物发生下列系列反应。图中的每一方格表示有关的一种主要反应物或生成物(反应中加入或生成的水以及生成的其它产物已略去),其中A、B、C、D、E在常温下均为高中化学中常见气态物质,X和K是中学常见的金属单质,氧化物Y是一种比较好的耐火材料。


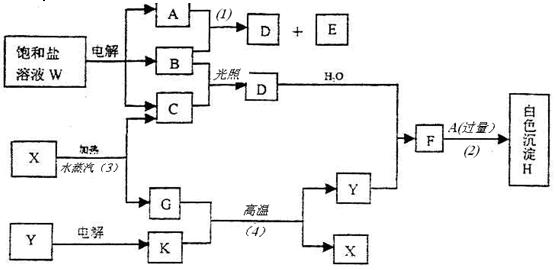
回答下列问题:


①W的名称是,G的俗名是。
②A分子的空间构型是,键角是°′。
③反应(3)的化学方程式是。
反应(4)的化学方程式是。
④饱和盐溶液W电解的离子方程式是。
⑤已知C的燃烧热为285.8kJ/mol。试写出C完全燃烧生成液态物质的热化学方程式。