燃煤烟气中含有大量的氮氧化合物(NOx)、二氧化硫和二氧化碳等,不宜直接排放到空气中,可采用以下措施对燃煤烟气进行处理。
(1)脱硝:选择性催化还原法的脱硝原理是在催化剂存在下,通入甲烷使氮氧化合物(NOx)转化为无害气体,发生如下反应:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)脱硫:①石灰石—石膏湿法烟气脱硫的工作原理是烟气中的二氧化硫与浆液中的碳酸钙以及鼓入的空气反应生成石膏(CaSO4·2H2O)。某电厂用煤400吨(煤中含硫质量分数为2.5%),若燃烧时煤中的硫全部转化成二氧化硫,用石膏湿法烟气脱硫中有96%的硫转化为石膏,则可生产石膏 吨。
② 新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由该铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中酸性氧化物分解除去,转化流程如图所示:
新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由该铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中酸性氧化物分解除去,转化流程如图所示: 若2molZnFe2Ox与足量SO2可生成1.0molS,
若2molZnFe2Ox与足量SO2可生成1.0molS,
则x= 。
(3)脱碳:从脱硝、脱硫后的烟气中获取二氧化碳,用二氧化碳合成甲醇是碳减排的新方向。将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①取五份等体体积CO2和H2的的混合气体(物质的量之比均为1:3),
分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图11所示,则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。
②在容积为1L的恒温密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下图12所示。若在上述平衡体系中再充0.5 mol CO2和1.5 mol H2O(g)(保持温度不变),则此平衡将 移动(填“向正反应方向”、“不”或“逆反应方向”)

③直接甲醇燃料电池结构如上图13所示。其工作时负极电极反应式可表示为 。
玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂由苯酚和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中缓慢加入甲醛,且反应釜应装有 装置;
(2)玻璃纤维由玻璃拉丝得到。制取普通玻璃主要反应的化学方程式为 ;
(3)玻璃钢中玻璃纤维的作用是 ;
(4)下列处理废旧热固性酚醛塑料的方法合理的是;
| A.深埋 | B.粉碎后用作树脂填料 |
| C.用作燃料 | D.用有机溶剂将其溶解,回收树脂 |
下表是甲、乙、丙、丁四种有机物的有关信息;
| 甲 |
①能使溴的四氯化碳溶液褪色;②比例模型为: ③能与水在一定条件下反应生成丙 ③能与水在一定条件下反应生成丙 |
| 乙 |
①由C、H两种元素组成;②球棍模型为 |
| 丙 |
①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与丁反应生成戊 |
| 丁 |
①由C、H、O三种元素组成;②球棍模型为 |
根据表中信息回答下列问题:
(1)写出与甲互为同系物,且比甲多一个碳原子的有机物在一定条件下生成的高分子化合物的结构简式 ;
(2)乙与液溴反应的化学方程式为 ;
(3)丙与丁反应能生成戊,戊为相对分子质量为100的酯,该反应类型为 ,其化学反应方程式为 ;(4)写出一种符合下列条件的戊的同分异构体的结构简式: ;
I.分子中不含支链并能使溴的四氯化碳溶液褪色
II.能与NaHCO3溶液发生反应
请根据表中数据回答有关问题:
| 酸或碱 |
电离常数(Ka或Kb) |
难(微)溶物 |
溶度积常数 |
| CH3COOH |
1.8×10-5 |
BaSO4 |
1×10-10 |
| HNO2 |
4.6×10-4 |
BaCO3 |
2.6×10-9 |
| HCN |
5×10-10 |
CaSO4 |
7×10-5 |
| HClO |
3×10-8 |
||
| NH3·H2O |
1.8×10-5 |
(1)表中所列四种酸中,酸性最弱的是 (用化学式表示)。下列能使醋酸溶液中CH3 COOH的电离度增大,而电离常数不变的操作是 (填序号);
A.升高温度B.加水稀释
C.加少量的CH3 COONa固体D.加少量冰醋酸
(2)已知纯水在100℃时的pH=6。该温度下0. lmol/L的NaOH溶液中,pH为 ;
(3)常温下,向水中加入少量醋酸铵固体,所得溶液呈中性,简述其原因 ;
(4)工业中制BaCl2时,需先将BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,欲使SO42-物质的量浓度达到0.01 mol/L以上,则溶液中CO32-物质的量浓度应≥_______mol/L;
元素周期表中第3周期元素的单质及其化合物的用途广泛。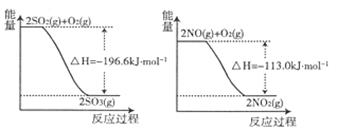
(1)该周期元素中,半径最小的简单离子的结构示意图为 ,最活泼金属元素和最活泼非金属元素形成的化合物的电子式为 ;
(2)氯的氧化物具有强氧化性,其中ClO2可将弱酸性废水中的Mn 2+转化为MnO2而除去,同时ClO2被还原为Cl--,该反应的离子方程式为 ;
(3)已知SO2,NO分别与O2反应过程中能量变化如图所示:写出NO2和SO2在一定条件下发生反应的热化学方程式 。
某化学研究性学习小组的同学在学习了电化学相关知识后,将所学知识整合得到如图所示装置,用于电解饱和食盐水。
请回答下列问题:
(1)甲池中Al极为 极,乙池中C2极为 极;
(2)甲池中发生反应的总化学方程式为 ;
(3)若向乙池中滴加酚酞试液,则C1极附近观察到的现象为 ,C2极的电极反应式为 ;
(4)当C1极析出224mL气体(标准状况)时,转移电子的物质的量为 。