在淀粉碘化钾溶液中加入少量NaClO溶液,振荡,溶液变蓝。在上述溶液中加入足量的Na2SO3溶液,蓝色逐渐消失。下列判断错误的是
| A.氧化性:ClO->I2 |
| B.蓝色逐渐消失说明Na2SO3具有漂白性 |
| C.漂白粉溶液可使淀粉碘化钾试纸变蓝 |
| D.向新制氯水中加入足量亚硫酸钠溶液,氯水褪色 |
盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以用盖斯定律间接求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出x kJ热量;已知每摩尔单质碳完全燃烧生成CO2放出热量为y kJ,则1 mol C与O2反应生成CO的反应热ΔH为
| A.-y kJ·mol-1 | B.-(10x-y)kJ·mol-1 |
| C.-(5x-0.5y)kJ·mol-1 | D.+(10x-y)kJ·mol-1 |
已知酸H2B在水溶液中存在下列关系:
①H2B=H++HB-,②HB- H++B2-,则下列说法中一定正确的是
H++B2-,则下列说法中一定正确的是
A.NaHB溶液不一定呈酸性,Na2B溶液不一定呈碱性
B.在Na2B溶液中一定有:c(Na+)=2c(B2-)+c(HB-)+c(H2B)
C.NaHB水溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+2c(B2-)
D.在Na2B溶液中一定有:2c(OH-)=c(H+)+c(HB-)
温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s |
0 |
50 |
150 |
250 |
350 |
| n(PCl3)/ mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
下列说法正确的是
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率小于80%
下列表述不正确的是
| A.对于一个确定的反应来说,平衡常数的数值越大,反应限度越大 |
| B.铝热反应会放出大量的热,因此常温下就能顺利发生 |
| C.碳酸铵[(NH4)2CO3]在室温下就能自发地分解产生氨气,碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大 |
D.对于化学反应COCl2(g)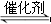 CO(g)+Cl2(g) ΔH<0当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率 CO(g)+Cl2(g) ΔH<0当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率 |
下列事实解释准确的是
| A.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。脱氧过程中铁作原电池正极,电极反应为:Fe-2 e-=Fe2+ |
| B.酸性氢氧燃料电池的正极电极反应为:2H2O+O2+4e-=4OH- |
| C.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,该反应的△S>0,说明反应△H>0 |
| D.铅蓄电池的正极反应为:PbO2+4H++2 e-=Pb2++2H2O |