(10分)化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行探究:
Ⅰ、查阅资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
Ⅱ、牙膏样品中碳酸钙的定量测定:
利用下图所示装置(图中夹持仪器略去)进行实验,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。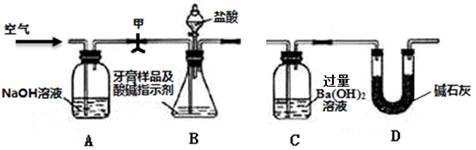
实验步骤:
如上图所示连接好装置,先检查装置的气密性;
准确称取牙膏样品的质量4.00g,并在各仪器中加入相应试剂;
打开弹簧夹甲,缓缓通入空气,然后接上C;
打开B的分液漏斗滴加盐酸反应,同时再次持续缓缓通入空气;
待B中不再产生气体后停止滴加盐酸;
将C中沉淀过滤、洗涤、干燥,得BaCO3;
称量BaCO3的质量为1.97g。
依据实验过程回答下列问题:
(1)步骤④通过空气的作用有:______________ __、___ __________。
(2)步骤⑥中检验沉淀洗干净的方法是 。
(3)本实验测定得到的样品中碳酸钙的质量分数为 。若采取下列措施,对测定结果的准确度没有影响的是_____________(填标号)。
a.省略步骤③ b.滴加盐酸快一些
c.在B、C之间增添盛有饱和NaHCO3溶液的洗气装置
d. 多次实验,取平均值计算
(4)有同学认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以准确测定碳酸钙的质量分数。请你说明是否可以并简要说明理 由 。
某铝合金中含有单质铝、镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验流程,请回答有关问题: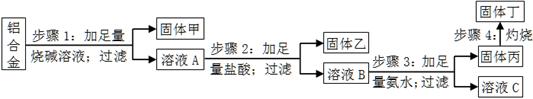
(1)步骤1所得固体甲的成分为。
(2)步骤2中加足量盐酸,而不采用通入足量二氧化碳的原因为。
(3)步骤3中生成固体丙的离子方程式为;溶液C中所含有的阳离子符号为。
(4)步骤4所发生反应的化学方程式为。
(5)现用托盘天平称取10.0g铝合金进行上述流程图所示操作,所得固体丁质量为15.3g,则该铝合金中铝的质量分数为;并判断以下操作对铝质量分数测定的影响(填“偏大”、“偏小”或“无影响”)。
a.步骤1中烧碱量不足,则;
b.步骤4中灼烧不充分,则。
氯化铝为白色的粉末,遇潮湿空气极易吸收水分并部分水解放出氯化氢而形成酸雾,在183℃升华。工业上由金属铝和氯气作用或用碳氯化法可制得无水氯化铝。某课外兴趣小组在实验室中,通过下图装置制取少量纯净的无水氯化铝。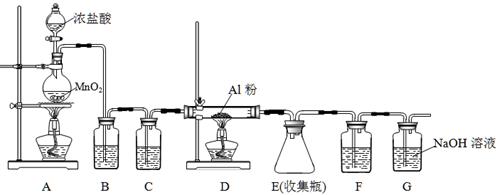
(1)装置A中用于盛装浓盐酸的仪器名称是,装置A可产生氯气和MnCl2溶液,该反应的化学方程式是。
(2)装置B中盛放饱和NaCl溶液,该装置的主要作用是。
(3)装置C、F均盛放浓硫酸,若取消装置C,则可能产生的不良影响是。
(4)装置D中预期观察到的现象是剧烈燃烧,发出白光,。
(5)另选一件仪器装入适当试剂后,也可起到F和G的作用,所装填的试剂名称为。
(6)工业碳氯化法制无水氯化铝是对氧化铝、碳和氯气进行加热,可得副产品一氧化碳,该反应的化学方程式是。
小王同学准备用CuSO4·5H2O配制480 mL 1 mol/L的溶液。
(1)小王同学选用的容量瓶容积的规格是mL;
(2)玻璃棒在该实验中有重要的用途,分别是
和 ;
(3)小王同学通过计算,决定称取g CuSO4·5H2O。
(4)物质的量浓度误差分析:(填偏高、偏低、无影响)
①若容量瓶洗净后未干燥,残留少量水,则所配制的溶液浓度将;
②定容时,若眼睛俯视,则所配制的溶液浓度将。
某校化学研究性小组,利用下列提供的实验装置和试剂对某种燃煤所
含元素进行定性和定量检测,试回答: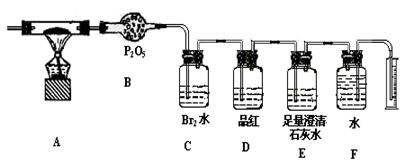
(1)将燃煤充分燃烧,产生气体经化学分析主要含有CO2、H2O、SO2、N2四种气体,则该燃煤一定含有的元素为.
(2)称取该燃煤样品Wg,通入纯氧使其充分燃烧,检测该燃煤中所含上述元素的质量分数。利用下列装置进行实验:
①指出上述装置中B、C、D、E的作用
BC
DE
②为了准确测量F中收集到的气体体积并能根据实验时温度、压强计算其物质的量,正确的实验操作是
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。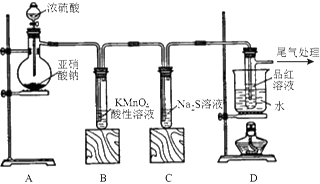
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是,A中发生反应的化学方程式为;
(2)实验过程中,装置B、C中发生的现象分别是、,这些现象分别说明SO2具有的性质是和;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象;
(4)尾气可采用溶液吸收。