(14分)小奇同学在实验室开放日做了氧化铜和稀硫酸反应的实验后,发现实验桌上有一瓶标签残缺(如左下图所示)的NaOH溶液。为了测定此溶液的溶质质量分数,他决定利用氧化铜和稀硫酸反应后的废液。他将废液过滤,然后取100g滤液,慢慢滴加此NaOH溶液,加入NaOH溶液的质量 与生成沉淀质量的关系如右下图所示:
与生成沉淀质量的关系如右下图所示: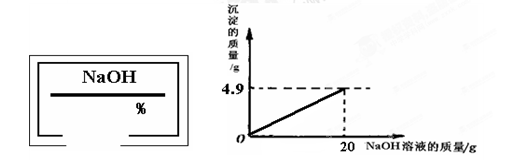
(1)计算100g滤液中CuSO4的质量;
(2)计算此氢氧化钠溶液中溶质的质量分数。
为测定贝壳中碳酸钙的含量,小红将贝壳粉碎后,取样品l0g,与足量的稀盐酸充分反应(杂质不与盐酸反应),产生二氧化碳1.76g。计算贝壳中碳酸钙的质量分数。
某工厂需要200kg氢气制备高纯度硅。若用电解水的方法制取这些氢气,需消耗水的质量是多少?(2H2O ====2H2↑+O2↑)
由铁元素和氧元素组成的铁的某种氧化物中,铁和氧的质量比为21:8,该氧化物的相对分子质量为232,试通过计算确定该氧化物的化学式。
硝酸铵的化学式为NH4NO3。求
(1)硝酸铵的相对分子质量。
(2)硝酸铵中O、N、H的质量比。
(3)硝酸铵中N的质量分数。
(4) 40 kg硝酸铵中N的质量。
我国从1994年开始强制食盐加碘,即在食盐中加入碘酸钾(KIO3),以防治碘缺乏病的发生,今年将适当下调现行食盐加碘量。各地将根据本地区实际情况作相应调整。深圳已率先作出调整,由原来每千克食盐含碘40 mg下调至25 mg。
(1)碘酸钾中碘元素、钾元素、氧元素的质量比为______________;
(2)碘酸钾中碘元素的质量分数为_______;(保留至0.1%或用分数表示)
(3)请为我市某企业计算:售往深圳的加碘食盐每袋(500 g)应比调整前少加碘酸钾多少毫克。